中国科大结合冷冻电镜及NMR等技术揭示钙敏感受体CaSR非对称激活的分子机制
近日,我校生命科学与医学部田长麟教授课题组首次解析了人源钙敏感受体(Ca2+Sensing Receptor, CaSR)与下游信号传导蛋白Gq的高分辨三维复合物结构,结合细胞信号转导和核磁共振(NMR)揭示了CaSR蛋白受体激动剂、正向别构调节剂等分子非对称激活的分子机制,相关研究成果以“Structural insights into asymmetric activation of the calcium-sensing receptor-Gq complex”为题于2023年11月2日在线发表在《Cell Research》杂志上。
钙离子敏感受体(CaSR)是C家族G蛋白偶联受体(GPCR)的一员,广泛分布于甲状旁腺、肠道、骨骼和肾脏等组织器官中。CaSR感应血液中钙离子的浓度,并通过平衡钙离子的吸收和外排从而维持人体中的钙离子平衡。由于钙离子参与信号传递、凝血、肌肉收缩、骨骼生成等众多重要生理活动,因此CaSR维持血钙稳定对人体生命活动至关重要,其功能异常将会导致各种疾病。
CaSR是人体中非常重要的药物靶标蛋白,目前已经有多个正向变构调节剂药物成功获批上市,它们分别结合在CaSR受体不同的靶点上:其中小分子药物cinacalcet和evocalcet结合在跨膜结构域;多肽药物Etelcalcetide结合在胞外VFT结构域;而小分子药物Upacicalcet则结合在胞外的芳香族氨基酸结合口袋中。CaSR激活的分子机制研究将进一步助力靶向该受体的药物研发。
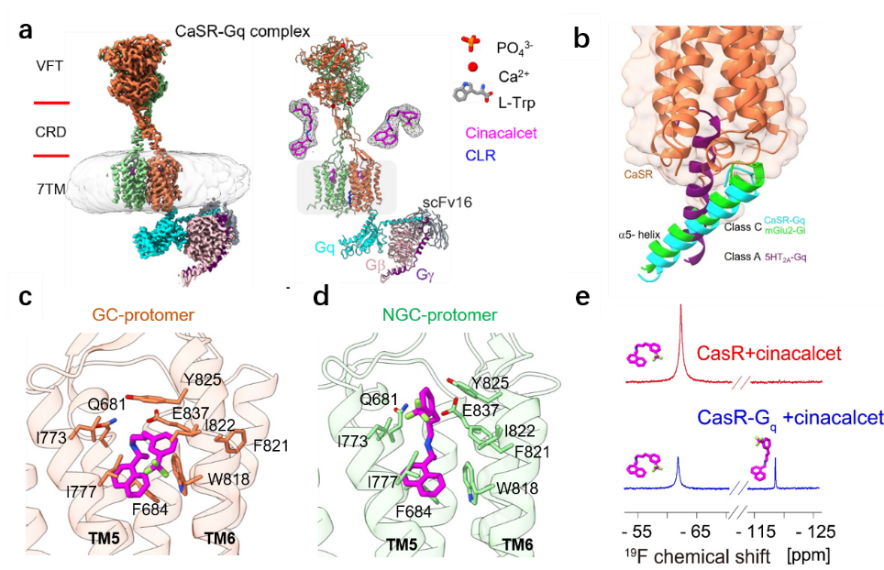
图1.CaSR在激动剂、别构调节剂作用下与下游信号转导蛋白Gq的非对称结合模式
针对CaSR这一重要的药物靶标蛋白,田长麟教授课题组开展了长期系统性的研究,2021年课题组国际上首次解析了全长CaSR蛋白的三维结构(Cell Research2021),揭示了受体在钙离子和芳香族氨基酸两种激动剂协同作用下,从非活性构象转变成活性构象的结构机制。在此之后,国际上多个课题组也相继在《Nature》《PNAS》《eLife》《Science Advances》等期刊上分别发表了CaSR受体在无配体、多个配体或别构调节剂结合的三维结构,分别提出了对称激活假说以及非对称激活假说。然而,由于缺少CaSR与下游信号蛋白G蛋白三聚体的复合物高分辨结构,其完整的激活机制仍然缺失。
经过近2年多的努力,田长麟教授课题组再次成功获得了CaSR-Gq复合物的高分辨冷冻电镜三维结构,结合细胞信号转导和NMR等实验揭示了CaSR在激活状态下结合Gq并启动下游信号传导的非对称激活机制。CaSR-Gq复合物结构也是目前第一个C家族GPCR与Gq结合的三维结构,揭示了其独特特点:(1)有别于A家族或B家族GPCR的Gq蛋白结合模式,其中Gq蛋白的α5螺旋没有插入CaSR胞内侧的跨膜螺旋深处,而是结合在受体胞内侧的一个非常浅的口袋中(主要由受体胞内loop和TM3胞内末端组成);(2)CaSR-Gq的结合模式与mGLuR-Gi, GABAB-Gi复合物的差异,体现了Gq与受体的特异性结合界面。
团队结合冷冻电镜与NMR技术,首次揭示了正向别构调节药物分子cinacalcet在受体信号复合物中的多样结合模式:cinacalcet以伸展(extended)和弯曲(bent)两种不同的构象,分别结合在二聚体CaSR受体的两个跨膜结构域的胞外侧结合口袋中,其中只有结弯曲-cinacalcet的跨膜结构域的胞内能够偶联下游信号蛋白Gq。和其他GPCR(包括A家族、B家族、C家族等)类似,CaSR仅结合一个下游信号蛋白,且CaSR-Gq复合物整体处于非对称构象,而且受体的局部跨膜结构域也处于非对称构象,cinacalcet以两个完全不同的构象结合在两个跨膜结构域中。同时,CaSR单独受体(不含Gq蛋白)与cinacalcet的三维结构表明,尽管cinacalcet在两个跨膜结构域中都处于bent构象,但是CaSR受体本身仍然是处于非对称构象。
综合前期的研究成果,研究人员提出了完整的CaSR非对称激活机制,将完善了人们对C家族GPCR激活机制的理解,同时为靶向CaSR的精准调控药物研发提供了重要理论基础。
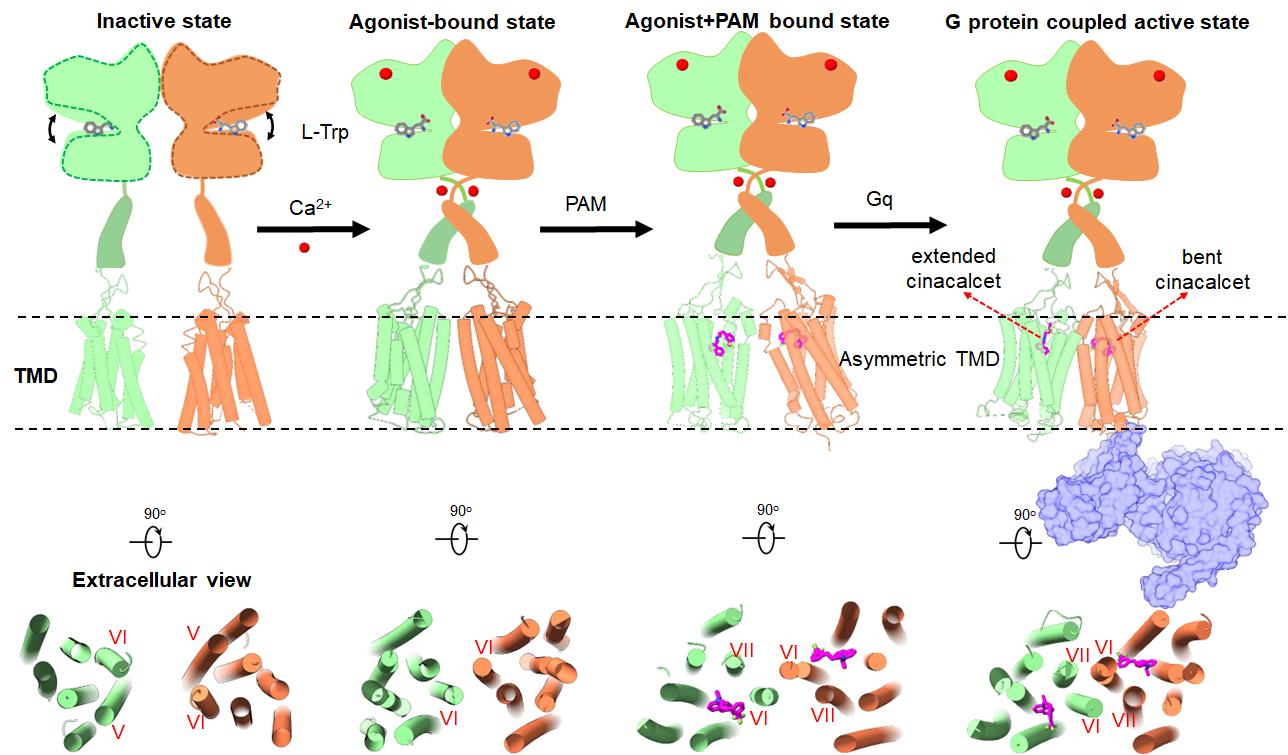
图2. CaSR非对称激活的分子机制模型
中科大生命与医学部的田长麟教授、凌盛龙副研究员、石攀副教授以及合肥微尺度物质科学国家研究中心的史朝为教授为该论文的共同通讯作者。田长麟教授课题组的凌盛龙副研究员与博士研究生孟宪禹为该论文的共同第一作者。冷冻电镜数据收集工作在中科大冷冻电镜中心完成,NMR数据收集工作在中科大生医部核磁共振中心完成。该研究得到国家自然科学基金、科技部、中国科学院和安徽省自然科学基金的经费资助。
论文链接:https://www.nature.com/articles/s41422-023-00892-2
(生命科学学院)