中国科学技术大学蔡刚教授课题组利用冷冻电镜技术,解析了染色质重塑SWI/SNF与INO80复合体及其不同核小体结合状态复合物的三维结构,揭示了SWI/SNF与INO80复合体共有的肌动蛋白(Actin)和核肌动蛋白相关蛋白(Arps)组成的Actin/Arp模块作为构象调控的分子开关,调控核小体结合及可能调节重塑核小体活性的分子机制,相关研究成果近日分别在国际权威杂志《Protein & Cell》和《Journal of Molecular Cell Biology》上发表。
染色质结构调控对于真核生物的基因转录、细胞周期发展、DNA复制、重组和损伤修复具有至关重要的意义。催化染色质结构改变的酶,包括组蛋白修饰(乙酰化、甲基化、磷酸化、泛素化以及类泛素化等)和染色质重塑(ATP依赖性的DNA移位酶),通常组装成多亚基的复合体来发挥功能。多个组蛋白修饰和染色质重塑复合体,都含有肌动蛋白(Actin)和肌动蛋白相关蛋白(Arps) 组成的Actin/Arp模块,如SWI/SNF(高等生物中的BAF)、INO80、SWR1和NuA4/TIP60等。目前对这些复杂复合体各个亚基在复合体中的定位及其在复合体组装和稳定中的贡献,以及如何重塑核小体结构的分子机制知之甚少。
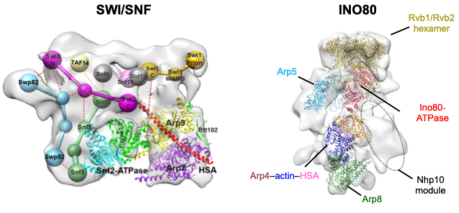
蔡刚教授课题组针对这些难题展开攻坚。经过大量系统尝试,克服了重重困难,分别获得了SWI/SNF与INO80复合体完整复合体的高质量生化制备和冷冻电镜三维结构,但是分辨率受限于染色质重塑复合体显著的结构柔性,无法从结构上鉴定各个亚基的空间位置和相互作用。蔡刚研究组采取“庖丁解牛”的研究策略,通过细致比较完整复合体及其各个亚基缺失突变体的精细三维结构,首次阐明了SWI/SNF和INO80复合体的亚基组织架构和亚基间的相互作用,建立了各个亚基的生物学功能和复合体组装和功能调控的直接联系。
此外,蔡刚课题组解析了SWI/SNF催化核心亚复合体和INO80 Actin/Arp模块及其结合核小体底物的不同重塑状态的精细三维结构,发现了SWI/SNF和INO80复合体共有的Actin/Arp模块首先结合核小体,通过Actin/Arp模块显著的构象变化,帮助核小体加载到催化核心的ATPase结构域。高度柔性的Actin/Arp模块不仅构成了染色质重塑复合体结合核小体的构象开关,而且有可能通过直接调节ATPase结构域的构象,调控着SWI/SNF和INO80染色质重塑的活性。
该成果对揭示染色质重塑复合体重塑核小体结构的分子机制,理解基因表达及其调控的分子机制,细胞增殖、发育及分化的机理具有重大意义,并有可能为新型肿瘤治疗药物的开发、干细胞分化与重新编程的改造奠定理论基础。
蔡刚实验室的博士研究生张智慧和张旋分别是两篇论文的第一作者,蔡刚教授和王雪娟研究员同为共同通讯作者。该项工作得到了基金委、科技部和合肥微尺度物质科学国家研究中心的资助,并得到了中科院生物物理所生物成像中心的仪器和技术支持。
两篇文章链接分别为:
https://link.springer.com/article/10.1007%2Fs13238-018-0524-9
https://academic.oup.com/jmcb/advance-article-abstract/doi/10.1093/jmcb/mjy062/5156286
(生命科学学院、科研部)