游离脂肪酸(Free fatty acids, FFAs)由甘油三酯在脂解后产生,可以通过一组G蛋白偶联受体(G protein-coupled receptors, GPCR)发出信号,在代谢、炎症和免疫中发挥作用。GPR84属于A类GPCR与下游Gi通路偶联,已被认为可以识别内源性中链脂肪酸(Medium-chain fatty acids, MCFAs),但不能识别短链(Short-chain fatty acids, SCFAs)或长链脂肪酸(Long-chain fatty acids, LCFAs)。
GPR84主要在外周单核细胞、巨噬细胞、中性粒细胞等免疫细胞中表达,在炎症条件下表达会被强烈上调。研究表明GPR84信号在各种病理条件下具有促炎功能,已成为治疗炎症和纤维化疾病的潜在药物靶点。目前已有两种药物PBI-4050和GLPG1205在治疗肺纤维化的临床试验中进行了测试,但未报道有明显的治疗效果。
GPR84信号转导的免疫功能之一是促进巨噬细胞吞噬。人类肿瘤RNA测序数据的分析也显示GPR84在肿瘤相关巨噬细胞(Tumor-associated macrophages, TAM)中特异性表达。这些数据表明,GPR84-Gi信号轴在介导巨噬细胞,特别是TAM对癌细胞的吞噬活性中起着关键作用。阻断这些信号与其表达在巨噬细胞上的受体相互作用会触发癌细胞吞噬,从而在小鼠癌症模型和临床试验中产生有希望的抗癌效果。
2023年9月14日,中国科学技术大学龚为民课题组与美国匹兹堡大学Cheng Zhang课题组, 新加坡科技研究局Hao Fan课题组, 美国希望之城综合癌症中心Mingye Feng课题组以及英国格拉斯哥大学Graeme Milligan课题组合作,在Nature Communications上发表题为“Pro-phagocytic function and structural basis of GPR84 signaling”的研究论文,研究团队报道了分辨率为3.0Å 的合成激动剂6-OAU结合GPR84受体与Gi复合物的冷冻电子显微镜(Cryo-electron microscopy, cryo-EM)结构,为针对GPR84受体的功能探索,以及设计与筛选出该受体的合理药物或有效化学工具奠定了结构基础。

首先研究人员为了探索激活GPR84信号在癌症中的治疗潜力,利用CD47阻断抗体B6H12测试了6-OAU对骨髓源性巨噬细胞(Bone marrow-derived macrophages, BMDMs)吞噬癌细胞的影响。6-OAU能以浓度依赖的方式促进BMDMs对Raji细胞(一种人类非霍奇金淋巴瘤细胞系)的吞噬(图1a)。使用GPR84特异性拮抗剂GLPG1205来阻断GPR84激活信号,结果显示消除了6-OAU的促吞噬作用,同时该作用也被Gi蛋白阻断剂百日咳毒素(Pertussis toxin, PTX)的预处理所消除,证实GPR84的促吞噬作用依赖于Gi信号转导(图1b)。CRISPR-Cas9敲低原代巨噬细胞中GPR84的表达,同样消除了6-OAU的促吞噬作用(图1c),进一步支持巨噬细胞中GPR84-Gi信号轴的激活可以与CD47阻断协同作用,驱动癌细胞的吞噬。
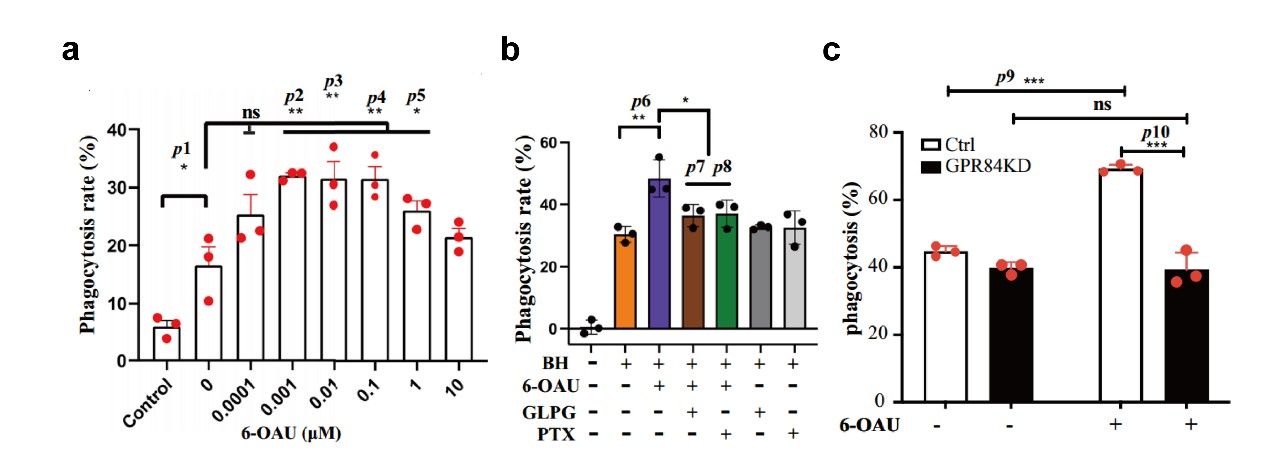
图1. GPR84-Gi信号促进癌细胞吞噬。(a) 6-OAU的剂量依赖性促吞噬作用;(b) GLPG1205和百日咳毒素可消除6-OAU的促吞噬作用;(c)巨噬细胞中GPR84的表达下调可消除6-OAU的促吞噬作用。
通过结构解析,科研人员揭示了一个完全封闭的6-OAU结合袋(图2a, 2b)。受体激活的分子基础涉及GPR84的非保守结构基序(图2c)以及受体特异性的Gi偶联模式(图2d)。结合分子对接和分子动力学模拟研究,该结构也提示了GPR84对MCFAs具有高选择性的机制以及配体结合和解离的潜在途径(图2e)。这些结果为理解GPR84信号通路和开发靶向GPR84的新药提供了框架。
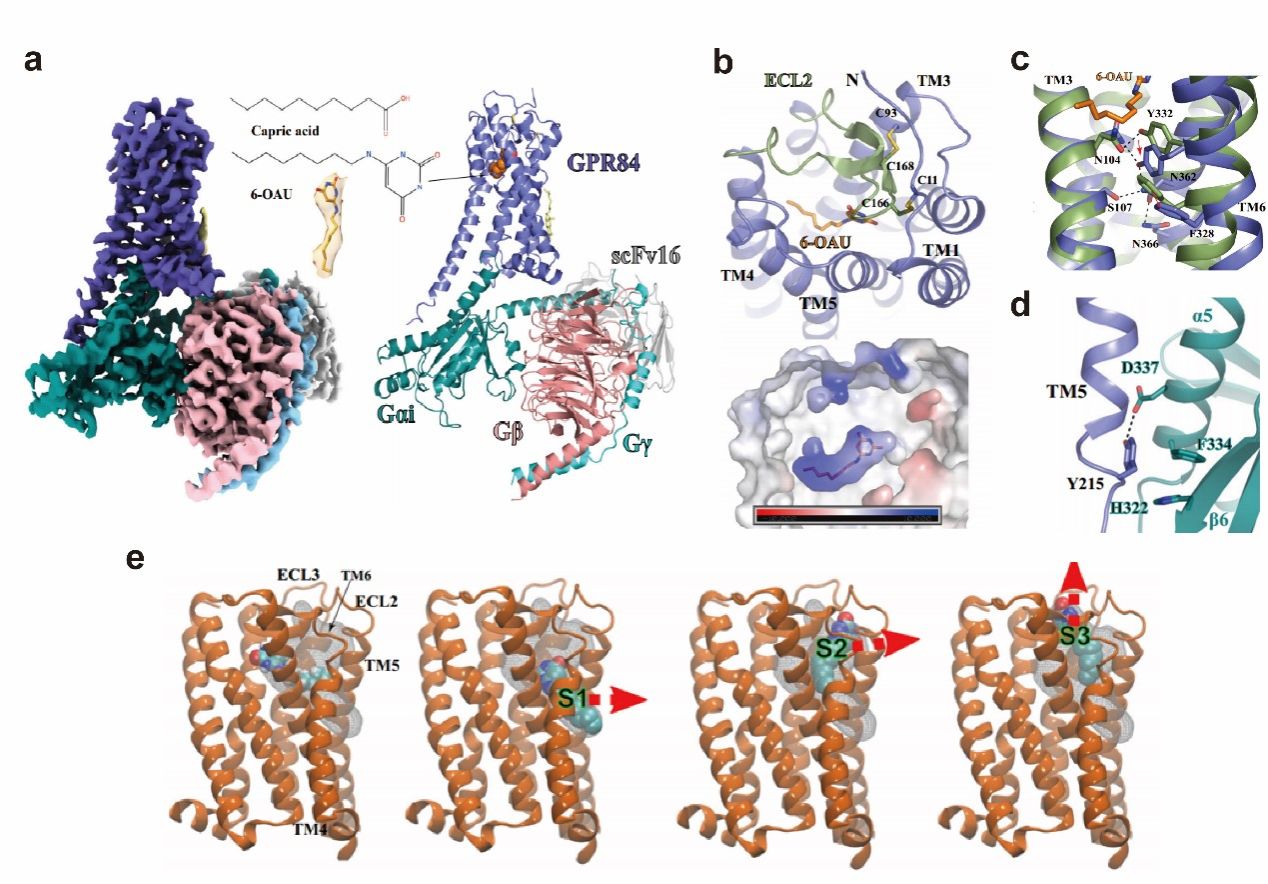
图2. 6-OAU-GPR84-Gi复合物的结构。(a) 6-OAU-GPR84-Gi复合物的低温电镜密度图及整体结构;(b) ECL2覆盖的6-OAU封闭结合口袋;(c) 参与GPR84核心区域受体激活的残基;(d)GPR84的TM5 C端与Gαi的相互作用;(e) MD模拟中假定的6-OAU出口路线。
本研究中冷冻电镜数据在中国科学技术大学冷冻电镜中心收集。Cheng Zhang教授,龚为民教授,Hao Fan教授,Mingye Feng教授以及Graeme Milligan教授为该论文的共同通讯作者。中国科学技术大学特任副研究员张旋(现匹兹堡大学博士后)、博士生王育婧以及新加坡科技研究局博士后Shreyas Supekar为该论文的共同第一作者。该研究得到了国家自然科学基金委、科技部等机构的经费资助。
原文链接:https://www.nature.com/articles/s41467-023-41201-0
(合肥微尺度物质科学国家研究中心、科研部)