中国科大在人类癌症细胞的多药耐药蛋白的结构和功能研究领域取得进展
药物治疗(化疗、靶向或免疫药物)是非常重要的癌症治疗手段。但是随着用药时间的推移,癌细胞几乎会对所有药物产生耐药性,最终导致治疗失败。多药耐药ABC转运蛋白介导的药物外排是一种常见的癌细胞耐药机制。ABC转运蛋白具有广泛的底物谱,能够从细胞外排许多外源性化学物质,包括长春花生物碱、鬼臼素、蒽环类药物、紫杉烷类和激酶抑制剂等。因此,在一线临床化疗过程中,由于它们对药物的外排,使得治疗效果大大减弱甚至消失。
人类ABC转运蛋白C亚家族成员ABCC3(亦称多药耐药蛋白MRP3)广泛表达于各种组织,如肾上腺、肝脏、胰腺、胆囊和小肠。其拥有广泛的底物特异性,除了转运外源药物而导致耐药性,还能够运输各种内源代谢物,如葡萄糖醛酸胆红素、胆汁酸和类固醇激素。因此,ABCC3参与体内多种生理过程,与人类疾病密切关联,例如胆汁酸和雌激素在细胞内积累导致的妊娠期肝内胆汁淤积 (ICP)。
近日,中国科学技术大学生命科学与医学部陈宇星教授和周丛照教授课题组,利用单颗粒冷冻电镜技术解析了人类ABCC3无配基结合 (apo-form)以及生理底物—葡萄糖醛酸雌二醇 (E217βG) 和硫酸脱氢表雄酮 (DHEAS) 结合的蛋白质结构,整体分辨率分别为3.1、3.7和3.5Å。基于蛋白质结构分析以及生化分析的结果,作者发现ABCC3具有一个双亲性的底物结合口袋,两个缀合的激素分子以不对称方式占据该底物口袋。结合以前的文献报道,作者提出了同类多药耐药蛋白底物结合口袋的共同特征,为合理设计MRPs的抑制剂提供了方向。相关研究成果以 “Placing steroid hormones within the human ABCC3 transporter reveals a compatible amphiphilic substrate-binding pocket” 为题于2023年7月24日在线发表在《TheEMBO Journal》上。
结构分析表明,apo-form ABCC3结构呈现向细胞质基质开口 (inward-facing) 的构象:两个核苷酸结合结构域 (NBD) 彼此分开,两个跨膜结构域 (TMD) 形成一个朝向细胞质基质开放的“V形”底物转运通道。与经典的ABC转运蛋白不同,其N端有一个额外的五股跨膜螺旋组成的TMD0结构域。TMD0的五股跨膜螺旋聚拢在一起,形成一个紧凑而独立的结构域(图1)。TMD0上的第二股跨膜螺旋(transmembrane helix, TM)TM2通过与TMD1上的TM6形成一个约1700Å2的相互作用界面,从而与核心结构域相互作用。但检测ABCC3的ATP水解酶活性以及放射性底物转运实验表明,TMD0结构域对ABCC3的转运功能并不是必须的,推测其可能影响ABCC3在极化细胞上的定位或者与其它蛋白有相互作用。
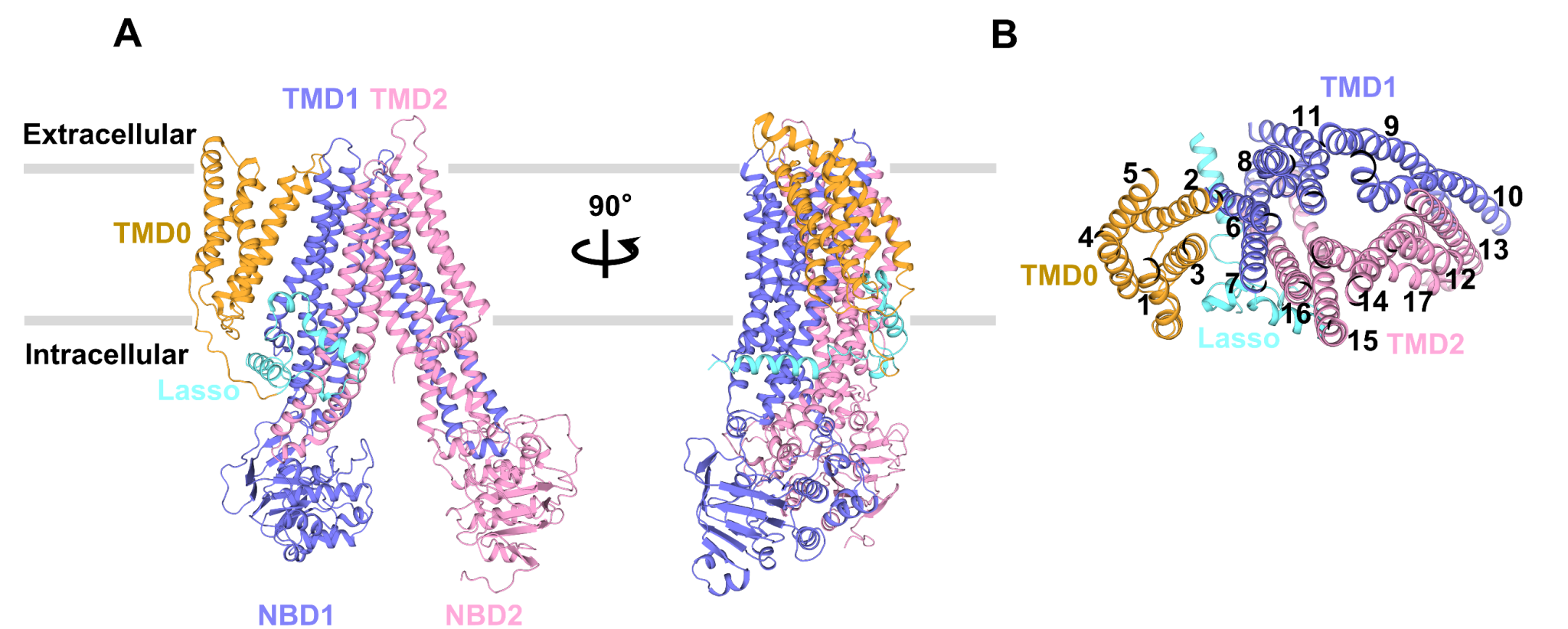
图1:apo-form ABCC3结构
结合底物E217βG的ABCC3仍然采用inward-facing构象,底物口袋关键残基的局部重排帮助E217βG分子的结合与固定。在该结构中,两个E217βG分子在空间中以“V型”协同结合在ABCC3内部。其中E217βG分子的疏水甾核占据疏水口袋汇并聚成“V型”的顶点,两个亲水的葡萄糖醛酸基团分别位于TMD1和TMD2两侧的碱性残基形成的极性口袋中(图2)。生化实验表明,位于TMD1一侧的两个碱性残基Arg1193和Arg1245对于E217βG分子的结合十分关键,它们的突变会导致底物刺激的ATP酶活性完全消失,表明精氨酸的长侧链以及强碱性对于底物的结合是必要的。
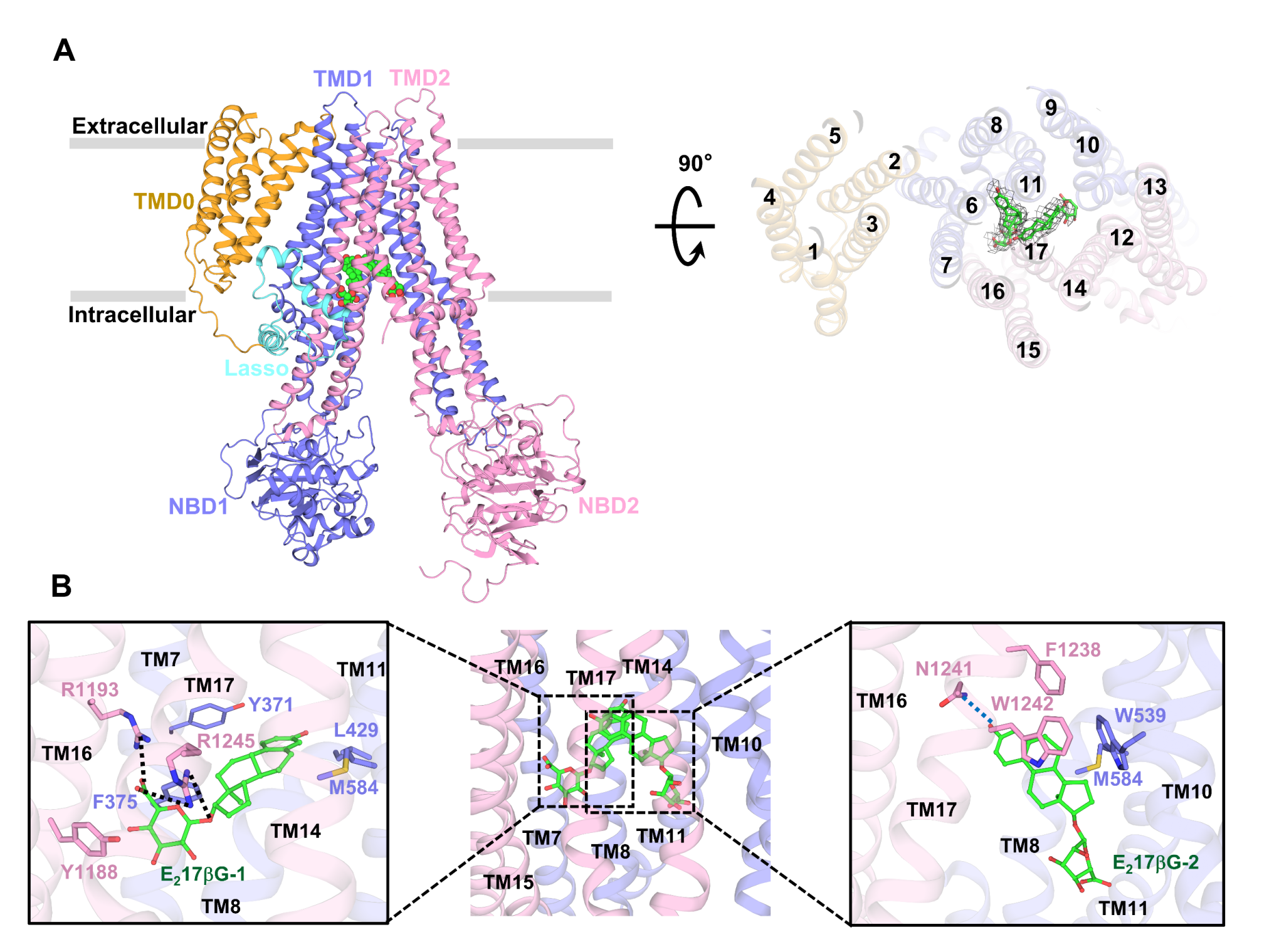
图2:E217βG底物结合口袋
尽管DHEAS和E217βG具有一个类似的疏水甾核,但E217βG的葡萄糖醛酸基团位于甾核的17′号位,而DHEAS的磺酸基位于甾核的3′位。在DHEAS结合的ABCC3结构中,有类似的“V型”结合模式(图3),但与E217βG相比, DHEAS分子的甾核呈现相反方向,从而使磺酸基也能够占据在TMD1和TMD2两侧的碱性口袋。 其磺酸基与TMD1上保守的两个精氨酸Arg1193与Arg124形成盐键,生化活性实验表明这些极性相互作用对DHEAS的识别非常重要。

图3:DHEAS结合位点
作者进一步分析了已报道的MRPs结构及其底物,发现它们都具有一个带负电荷的基团缀合到疏水的核心结构。ABCC3的底物结合口袋除了拥有两个正电的亲水区域外,还有一个较大的疏水腔,因此正好契合底物的相互结合。TMD1一侧存在一簇碱性残基且在MRPs中高度保守;相比较之下位于TMD2一侧的亲水区域的正电性较弱且保守性较差。因此,作者根据底物的大小以及缀合方式的不同,将MRPs的底物分为三类,并提出相应的底物结合方式(图4)。总之,该研究不仅阐明了ABCC3特异性识别底物的分子机制,而且还提出了所有MRPs共同的底物结合模式,进一步拓宽了我们对多药耐药分子机制的理解。
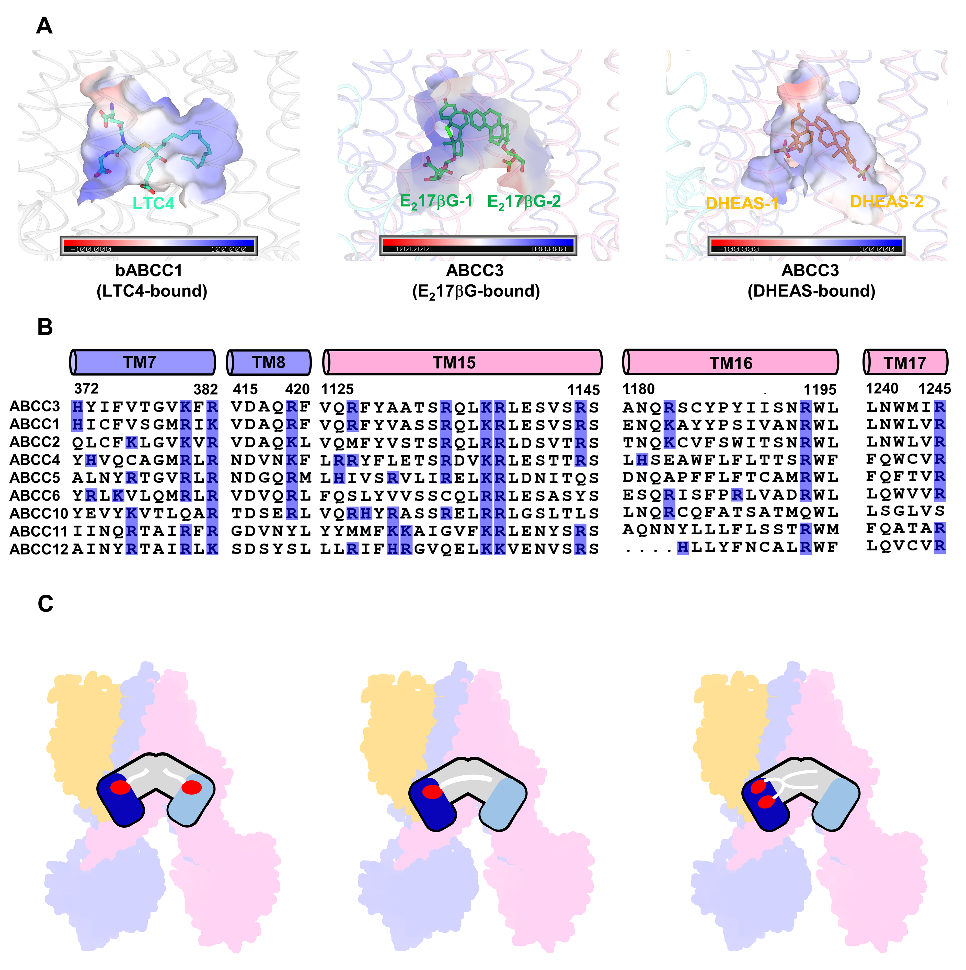
图4:MRPs底物结合模式
中国科学技术大学陈宇星教授、周丛照教授和侯文韬副教授为该论文的共同通讯作者,博士生王洁为该论文的第一作者。冷冻电镜数据收集工作在中国科学院北京生物物理研究所和中国科学技术大学集成影像中心完成。该研究得到了科技部、国家自然科学基金委、中国科学院和中国科学技术大学等机构的资助。
原文链接:https://doi.org/10.15252/embj.2022113415
(生命科学与医学部、科研部)