自剪接内含子(核酶)是具有催化活性的RNA,主要参与RNA的加工与成熟。与蛋白酶类似,核酶也会折叠成高级结构发挥功能。RNA在一级序列的基础上形成局部的helix、loop等二级结构元件,再在金属离子的帮助下进一步折叠成具有酶活中心的三级结构,在无需蛋白质的情况下催化反应。但由于RNA的异质性和灵活性,使RNA结构的解析受到了很大的挑战,限制了人们对其结构和功能间联系的理解。
在许多生物体中,I型核酶通过两个连续的酯交换反应催化自身从RNA前体中切除。嗜热四膜虫I型核酶是第一个被发现的核酶,自20世纪80年代被发现以来,大量的生物化学和遗传学研究已经阐明了四膜虫核酶的潜在催化机制,但获得其全长分子的三维(3D)结构以及其催化功能所需的3D结构中的详细重排一直是重大的科学挑战。张凯铭等团队此前首次解析了四膜虫核酶的全长结构(Nature 2021),并解析了多个不同构象错误折叠的四膜虫核酶结构(PNAS 2022),为冷冻电镜解析高分辨率RNA结构做出了表率。
为了解析四膜虫核酶催化的结构基础以及伴随两步自剪接反应的构象变化,张凯铭课题组分别进行了第一步和第二步剪接反应底物的设计,并通过冷冻电镜解析了四膜虫核酶第一步剪接过程中的四种构象(Nucleic Acids Research 2023)和第二步剪接过程中的六种构象(Nature Communications 2023),深入剖析了四膜虫核酶的剪接机制。


研究人员首先在体外验证了设计后的底物可以完成催化反应,并确定了核酶与底物的最优反应条件,然后利用单颗粒冷冻电镜在解析高异质性或灵活性的样品方面的独特优势,捕获了四膜虫核酶自剪接过程中的多种不同构象(图1)。
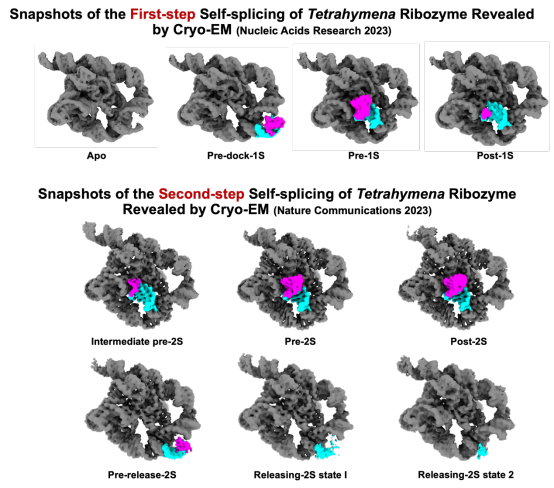
图1.冷冻电镜解析四膜虫核酶两步自剪接过程中的多种不同构象。
通过结构比对,在四膜虫核酶的第一步剪接反应过程中,核酶5′端的IGS/IGSext与5′剪接底物配对形成P1/P1ext双链(pre-dock-1S),其会围绕J1/2发生~50 Å的移动将底物带至核酶催化活性中心(pre-1S)。P1和催化活性中心内的三个单链片段(J8/7、J4/5、J5/4)之间的三级相互作用介导了P1/P1ext双链的正确定位。随后,早已占据活性位点的外源GTP的3′-OH对5′剪接位点进行亲核攻击,完成第一步转酯反应(post-1S)。在第二步剪接反应过程中,3'剪接底物取代外源GTP,P7ext形成并引导3' -剪接底物结合,形成部分P10双链 (intermediate pre-2S)。随后完整P10双链的形成使3'剪接位点靠近酶活位点,为第二次酯交换反应做好准备(pre-2S)。完成第二步转酯反应后(post-2S),P1/P10双链离开活性位点,围绕J1/2发生~50 Å的移动将连接产物带至无底物位点(pre-release 2S),然后经历解旋过程释放产物(releasing states)。概况来说,在四膜虫核酶的自剪接过程中,核酶发挥功能的同时伴随着构象的显著改变,这种变化主要集中在核酶5′端的IGS/IGSext(图2)。此外,研究人员发现除构象改变外,活性位点的金属离子和一些氢键也会发生细微重排,以促进催化和协调自剪接反应。

图2.自剪接过程中四膜虫核酶构象变化的示意图。P表示碱基配对区域。
这些研究结果使得核酶的功能在原子水平上得到了更好的剖析,并突出了冷冻电镜捕获动态RNA结构改变的能力。随着冷冻电镜在结构异质性分子中应用的不断推进,研究人员预计它将成为探索越来越多生物学上有趣的研究课题的关键工具,比如RNA系统的折叠和组装。
中国科学技术大学生命科学与医学部的博士研究生张晓静和李珊珊副研究员为(Nucleic Acids Research 2023)的共同第一作者,李珊珊副研究员为(Nature Communications 2023)的第一作者,张凯铭教授和李珊珊副研究员为两篇文章的共同通讯作者。这两项工作中冷冻样品初筛、数据收集与处理在中国科学技术大学冷冻电镜中心完成,该工作也获得了细胞动力学重点实验室的大力支持。研究工作的开展得到了科技部重点研发计划、中科大科研启动经费和中科院率先行动引才计划择优经费的资助。
原文链接:
https://academic.oup.com/nar/article/51/3/1317/6993854
https://www.nature.com/articles/s41467-023-36724-5
(生命科学与医学部、科研部)