中国科大细胞动力学教育部重点实验室姚雪彪、刘行联合团队阐明了EB1蛋白相分离调控纺锤体动力学与细胞分裂命运抉择的物理化学机制,向解析生物大分子凝聚态调控细胞命运可塑性理论研究迈出了重要一步。这一研究成果于北京时间12月20日发表在国际权威学术期刊《自然-细胞生物学》杂志上。
细胞是生命活动的最小功能单元,生物大分子通过构筑形态与功能各异的区室,精准催化生物化学反应,调控细胞的稳态与增殖质量。细胞骨架是其区室化的物质基础,参与细胞生长、细胞形态、细胞间信息交流与细胞选择性应答胞外微环境的命运可塑性。1967年,美国芝加哥大学Borisy & Taylor在探索细胞分裂分子机制时,利用秋水仙碱作为化学探针发现与纯化了微管蛋白,并发现微管蛋白可组装成25纳米外径的真空管 [J Cell Biol. 34, 525 (1967)]。随后,美国加州大学旧金山分校Cleveland & Kirschner克隆了α,β-微管蛋白的基因并测定了其氨基酸序列[Cell. 15, 1021 (1978); Nature. 289, 650 (1981)],确定了β-微管蛋白催化GTP的化学特征。鉴于微管蛋白聚合组装过程中展现的物质性状,Mitchison & Kirschner在1984年提出了“Dynamic Instability”模型,用于解释微管的动态规律与β-微管蛋白在正末端的稳定性。此后,美国加州大学伯克利分校Nogales研究组解析了高分辨冷冻电镜微管三维结构 [Cell. 162, 849 (2015)],但是由于微管组装与解聚高度动态,实验无法捕获微管组装与解聚反应过程的中间态结构,微管组装与解聚物理化学机制与Dynamic Instability的化学基础至今仍不清晰。
1995年,美国约翰霍普金斯大学Vogelstein研究组在解析家族性直肠癌基因APC突变体功能易感性时发现了APC的重要调控蛋白EB1 [Cancer Res. 55, 2972 (1995)]。随后的研究提示:APC通过EB1与微管连接,维系细胞分裂过程的基因组稳定性,家族性直肠癌基因APC突变体缺失与EB1结合能力,从而导致染色体不稳定性。但是,EB1如何招募众多的APC类蛋白(人类基因组显示约有1000种含SxIP基序蛋白)与动态变化的β-微管蛋白结合一直是细胞生物学、生物物理学与分子病理学未解答的问题。
中国科大细胞动力学研究团队在解析细胞分裂微管动力学机制时,于2009年发现与克隆了一个新颖的EB1结合蛋白TIP150 [EMBO Rep. 10, 857 (2009)]。TIP150含有典型EB1结合蛋白基序SxIP,负责招募微管解聚酶MCAK,在动态组装微管的正末端形成催化区室。在此基础上,研究团队在2012年采用单分子技术TIRFM与FRET,解析了EB1与TIP150的动态作用机制与化学基础[PNAS. 109, 16564 (2012)]。由于EB1选择性识别与结合正在聚合的动态微管结构,EB1的构效关联研究也成为解析微管Dynamic Instability的有效路径。但是EB1含有较长的柔性区域,无法获得全长蛋白的三维结构,研究团队利用活细胞光敏定位超高分辨显微成像与荧光蛋白互补策略,发现了柔性区域碱性氨基酸在EB1二聚化与调控微管动态性的功能[MBoC. 25, 4166 (2014)]。利用多色单分子分析、非天然氨基酸嵌入与三维类器官多维度成像等方法,重点实验室联合团队揭示了EB1第66位赖氨酸动态巴豆酰化修饰与微管结合的动态调控机制及其对细胞分裂纺锤体定向稳定性维系的作用机制[Nature Chem Biol. 288, 1314 (2021)]。
随着结构照明成像技术的发展,研究人员发现了EB1蛋白在活细胞动态微管追踪过程的液滴表征,利用基因编辑、物理化学模拟碱性氨基酸的丰度与间隔,并结合超高分辨成像,揭示了EB1蛋白的相分离特征与凝聚态物质基础,解析了相分离驱动EB1蛋白的微管正端追踪功能。至此,联合团队阐明了EB1蛋白相分离调控纺锤体微管可塑性的物理化学机制,向解析生物大分子凝聚态调控细胞命运可塑性理论研究迈出了重要一步。此外,杂志同期发表了瑞士保罗谢尔研究所和苏黎世联邦理工学院以及荷兰代尔夫特理工大学的两篇合作论文,他们利用低等真核细胞酵母,证明了EB1酵母同源蛋白的相分离特征。
合肥微尺度物质科学国家研究中心宋晓玉副研究员、杨丰瑞博士、杨通通同学、丁明瑞博士、李林格同学与武汉大学汪勇同学为本论文的共同第一作者,项晟祺、许超、王志凯、符传孩、臧建业、侯中怀和施蕴渝院士等课题组参与了该项研究。
该研究工作得到了科技部、自然科学基金委、教育部、中科院、安徽省等的资助和支持。
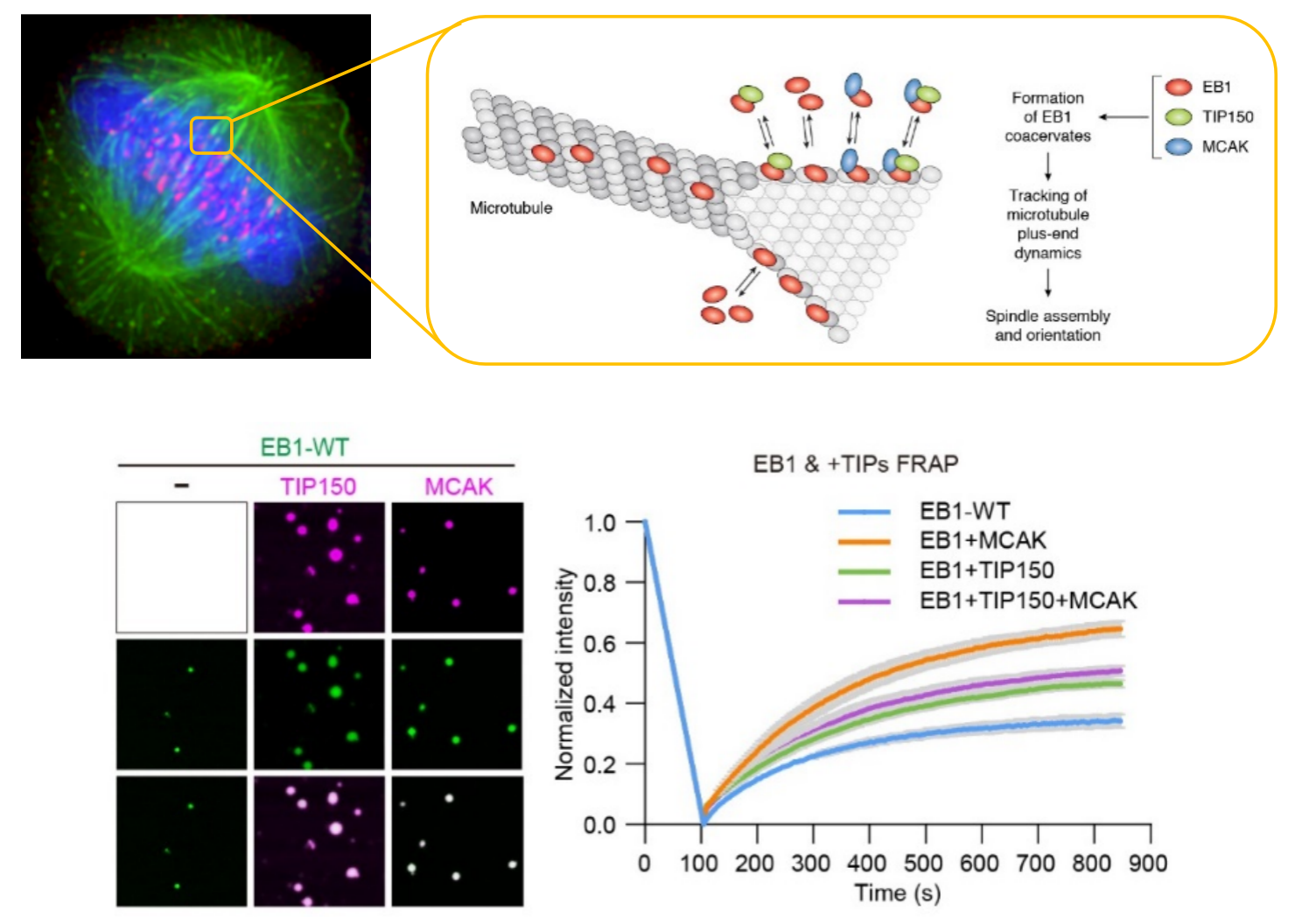
EB1蛋白相分离调控细胞分裂命运可塑性的示意图
论文链接:https://www.nature.com/articles/s41556-022-01033-4
(无膜细胞器与细胞动力学教育部重点实验室、合肥微尺度物质科学国家研究中心、生科院、科研部)