在RNA上存在多种修饰,其中腺嘌呤N6位甲基化(m6A)修饰是哺乳动物中丰度最高、分布最广的RNA修饰。研究发现m6A修饰在mRNA的编码区和3’ -UTR区域富集,参与多种生理及病理过程的调控。RNA的m6A修饰依赖由多个蛋白成员组成的m6A甲基化酶完全复合物(Holo-complex),其中由MT-A70家族蛋白METTL3和METTL14形成异源二聚体组成的催化亚基被称作m6A-METTL复合物(m6A-METTL complex,简称MAC);而WTAP、VIRMA(KIAA1942)、ZC3H13和HAKAI等主要起调控作用,并存在明显的相互作用,它们组成的调控亚基被称作m6A-METTL关联复合物(m6A-METTL associated complex,简称为MACOM)(图1a)。缺少MACOM时,MAC只显示相对较低的体外m6A修饰活性(图1c),因此MACOM对MAC的m6A甲基化酶活性具有重要的调控作用。虽然组成MAC核心的METTL3/14催化结构域以及METTL3的锌指结构已被解析1-4,但是对于调控复合物MACOM及其成员蛋白,仍缺乏任何结构信息,极大阻碍了对其功能和对催化亚基MAC活性的调控机制研究。
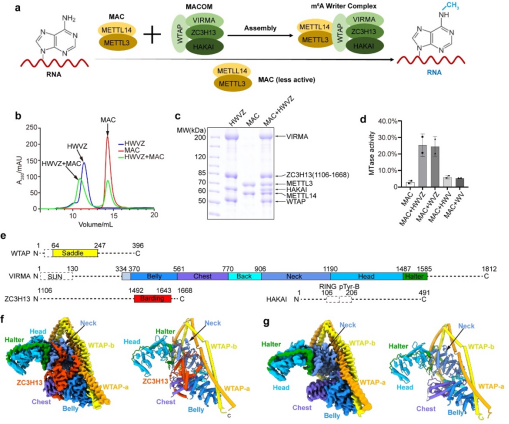
图1. MAC-MACOM的活性测试及MACOM复合物的整体结构。a, MAC-MACOM进行RNA m6A甲基化修饰的工作模型。b,c, MAC, HWVZ, MAC-HWVZ复合物尺寸排阻色谱峰图以及对应SDS-PAGE电泳图。d,使用Actb-1 RNA来比较单独MAC及其与不同组分MACOM复合物组合的m6A甲基化活性。e,所用人源MACOM复合物的结构域示意图。虚线代表电镜结构中不可见的区域。f, HWVZ复合物的电镜密度(左)与结构(右)示意图。g, HWV复合物的电镜密度(左)与结构(右)示意图。
2022年9月27日,中国科学技术大学生命科学与医学部张凯铭团队与复旦大学生命科学学院麻锦彪团队和合作在Cell Research杂志在线发表了题为《Cryo-EM structures of human m6A writer complexes》的文章,该研究首先体外获得了MACOM和MAC复合物(图1b-c),然后通过冷冻电镜解析了两套分辨率在3.0 Å的人源m6A甲基化酶调控亚基复合物MACOM的核心区域原子水平结构(图1f-g),以及整体分辨率为4.4 Å的人源m6A甲基化酶MAC-MACOM复合物整体结构。研究团队结合蛋白质-蛋白质和蛋白质-RNA交联质谱以及pull-down等生化实验与结构分析,阐明了MACOM复合物结构核心区域的组成及结构细节,并提出了MAC-MACOM甲基化修饰RNA的合理模型。

解析的MACOM复合物冷冻电镜结构整体形状类似“披戴马鞍的战马”。其中WTAP通过四段α-螺旋卷曲螺旋(coiled-coil)H1-H4形成了紧密的同源二聚体,H1-H4之间有三处linker区域链接并扭转(图2a),使得WTAP二聚体形成类似马鞍的形状。VIRMA则以20个ARM-like重复结构单元通过长连接螺旋等形成类似半身马型结构(图2b)。WTAP二聚体和VIRMA之间超过5000 Å2的相互作用界面以及保守、多模式、多区域的相互作用,使得二者紧密的结合,作为整个m6A甲基化酶复合物调控亚基的刚性骨架(图2c)。ZC3H13通过C端片段(1492-1643aa)深入结合在VIRMA的中心部分从而锚定在复合物上,并把VIRMA“撑开”6 Å左右的开口(图2d-e)。值得指出的是,虽然HAKAI在复合物纯化过程中一直存在,但在两个MACOM复合物的结构中都并未观察到(图1),因此HAKAI并不构成调控亚基的核心结构,很可能结合在外围灵活区域。
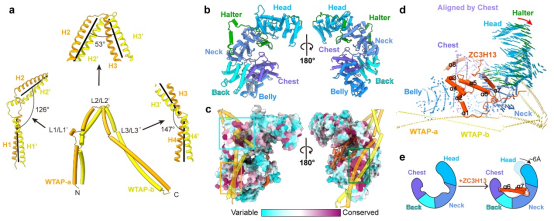
图2. WTAP、VIRMA、ZC3H13的结构及作用关系。a, WTAP的二聚体结构示意图。α-螺旋卷曲螺旋的轴用黑线表示。b, VIRMA的结构示意图。c, VIRMA的序列保守性示意图。WTAP与VIRMA相互作用的区域已用框标出。WTAP和ZC3H13均为半透明表示。d,e,以VIRMA的Belly和Chest结构域为参考,ZC3H13结合后HWV复合物的构象变化。e, ZC3H13的α6和α7结合导致的HWV复合物构象变化的模型。
为了获得m6A甲基化全酶复合物的结构信息,研究人员进一步解析了4.4 Å的MAC-MACOM复合物结构,其中MACOM复合物部分较清晰,而MAC部分密度较差,无法清晰辨识。但在WTAP-H4/H4’区域,出现了的高占有率α-螺旋密度(图3a),通过蛋白交联质谱与pull-down实验证明,此处的密度为METTL3 N端的Leader Helix,与此前报道的生化结果一致5。再通过调低冷冻电镜密度阈值,借助已解析的METTL3/14核心晶体结构和锌指溶液结构1-4,搭建出了MAC-MACOM复合物中两个亚基的相对空间关系(图3b,同时通过分析s4U标记的RNA底物与MAC-MACOM复合物的交联质谱结果,确定了RNA底物在MAC-MACOM复合物上的结合区域,提出了可能的m6A甲基化酶复合物修饰RNA底物的作用模型(图3c)。
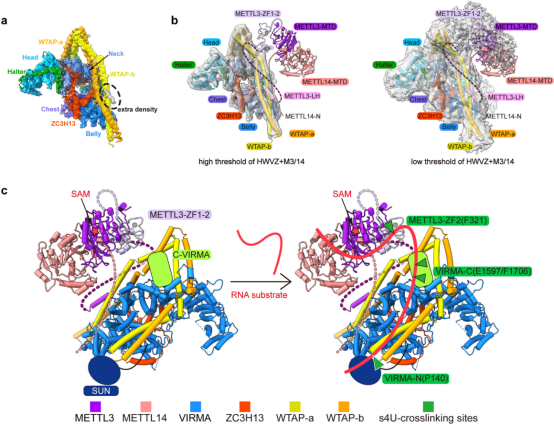
图3. MAC与MACOM复合物的相互作用以及整体的底物结合模式图。a,在高阈值下的MAC-MACOM复合物电镜密度中放入MACOM复合物的结构,多余密度用虚线圈出。b,基于电镜密度和生化结果的MAC-MACOM复合物模型,左图为高阈值密度图,右图为低阈值密度图。c,根据s4U-RNA和MAC-MACOM复合物的交联质谱结果提出的m6A甲基化酶复合物与RNA底物的作用模型。
总之,该研究首次解析了m6A修饰过程中其重要调控作用的MACOM复合物的高分辨冷冻电镜结构和全酶复合物(MAC+MACOM)核心结构模型,并进一步提出了合理的m6A甲基化酶复合物修饰RNA底物的作用模型。由此为开发针对m6A修饰的抑制剂或药物提供了除MAC催化亚基复合物以外的新靶点的结构基础,以实现对RNA m6A修饰相关癌症等人类疾病的潜在治疗目的。
复旦大学生命科学学院的苏世晨博士、中国科学技术大学生命科学与医学部的李珊珊副研究员以及复旦大学生命科学学院的博士生邓婷为本文共同第一作者,复旦大学生命科学学院和遗传工程国家重点实验室麻锦彪教授与中国科学技术大学生命科学与医学部张凯铭研究员为本文的共同通讯作者。中国科学技术大学细胞动力学重点实验室和冷冻电镜中心为数据收集与处理提供了支持,复旦大学生命科学学院和遗传工程国家重点实验室的电镜平台为样品初筛提供了支持。该项研究工作得到国家重点研发计划、国家自然科学基金、中科大科研启动经费和中科院率先行动引才计划择优经费的资助。
原文链接:https://www.nature.com/articles/s41422-022-00725-8
1Wang, X.et al.Structural basis of N6-adenosine methylation by the METTL3–METTL14 complex.Nature534, 575-578 (2016).
2Wang, P., Doxtader, K. A. & Nam, Y. Structural basis for cooperative function of Mettl3 and Mettl14 methyltransferases.MolecularCell63, 306-317 (2016).
3Śledź, P. & Jinek, M. Structural insights into the molecular mechanism of the m6A writer complex.eLife5, e18434 (2016).
4Huang, J.et al.Solution structure of the RNA recognition domain of METTL3-METTL14 N6-methyladenosine methyltransferase.Protein &Cell10, 272-284 (2019).
5Schöller, E.et al.Interactions, localization, and phosphorylation of the m6A generating METTL3–METTL14–WTAP complex.RNA24, 499-512 (2018).
(生命科学与医学部、科研部)