中国科大揭示了Gemin5 羧基端十聚体调控mRNA翻译的分子机制
我校生命科学与医学部许超教授、张凯铭教授与西班牙分子生物学中心Encarna Martínez-Salas教授利用单颗粒冷冻电镜技术解析了人源Gemin5 羧基端结构域(G5C)的三维结构,揭示了G5C结合mRNA并调控其翻译的分子机制。。相关成果以“Structural basis for Gemin5 decamer-mediated mRNA binding”为题于2022年9月2日在线发表在《Nature Communications》杂志。
Gemin5最早于运动神经元存活(SMN) 复合体中被发现,是SMN复合物中最大的亚基,其基因缺陷导致神经系统疾病的发生。2016年许超课题组在《Genes & Development》发表工作揭示了Gemin5 氨基端WD40结构域识别小核RNA(snRNA)的分子机制。G5C被报道与自身mRNA以及病毒RNA结合调控RNA翻译。研究者利用生物化学等手段发现G5C形成740 kD的均一超大复合体结构,并结合Gemin5 mRNA中一段含有stem loop的区域。通过解析G5C的冷冻电镜结构(整体分辨率3.31 Å)首次发现G5C羧基端通过疏水作用形成十聚体。该十聚体由两个闭合环状五聚体结构相互扭转108度,通过中间桥联的5对TPR二聚体连接而成,因而又可以被称作adimer of pentamers。这种双五聚体组成十聚体的构型在RNA结合蛋白质中还属首次发现。
结构生物学、生物化学、突变及细胞生物学实验表明:(1)破坏五聚体界面的突变无一例外的减弱G5C与mRNA的结合,表明G5C五聚体/十聚体形成对结合mRNA是必需的;(2)G5C十聚体通过内部相邻G5C的TPR结构域之间带正电狭长口袋结合mRNA;(3)细胞内破坏G5C五聚体/十聚体形成的突变,以及G5C TPR结构域带正电氨基酸的突变,都影响Gemin5调控mRNA翻译的功能;(4)Gemin5基因的部分致病突变预测将破坏G5C的十聚体形成,或成为导致神经系统疾病的重要原因。该研究解析了G5C十聚体作为一个整体结合自身mRNA并调控mRNA翻译的机制,为进一步研究Gemin5缺陷导致神经系统疾病的机理以及Gemin5独立于SMN复合物的生物学功能提供了结构基础。
我校生命科学与医学部的许超教授,张凯铭教授和西班牙分子生物学中心Encarna Martínez-Salas教授为该文章共同通讯作者。许超课题组博士生郭琼(已毕业),赵是栋,Encarna Martínez-Salas课题组的Rosario Francisco-Velilla为该论文共同第一作者。该项目得到了我校施蕴渝教授,姚雪彪教授,孙林峰教授,龚庆国教授,张家海工程师等支持。冷冻电镜数据收集工作在中国科学技术大学冷冻电镜中心完成。该研究得到了无膜细胞器与细胞动力学教育部重点实验室、微尺度国家研究中心、自然科学基金委的资助。
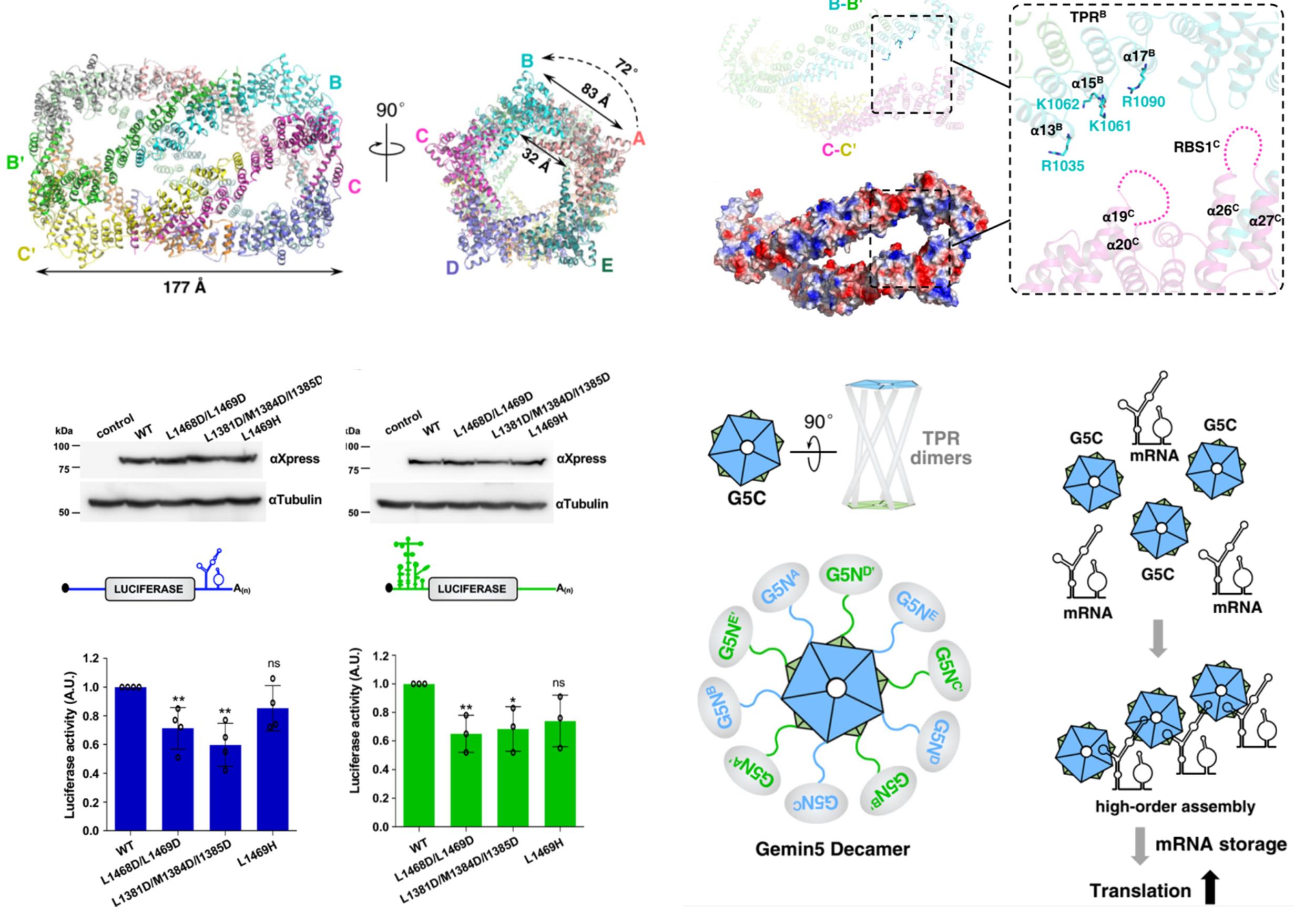
图:Gemin5 羧基端十聚体冷冻电镜结构及其调控mRNA翻译的分子机制
文章链接:https://www.nature.com/articles/s41467-022-32883-z
(生命科学与医学部、科研部)