人类ABCD1属于ABC转运蛋白超家族ABCD亚家族,定位于过氧化物酶体膜上,能够利用ATP水解产生的能量将超长链脂酰辅酶A (VLCFA-CoA)从细胞质转运到过氧化物酶体中进行β-氧化。ABCD1功能缺陷会使得超长链脂肪酸在细胞中积累,导致伴X-染色体肾上腺脑白质营养不良症(X-ALD)(图1)。作为最常见的过氧化物酶体疾病,X-ALD在人群中的发病率约为1/17,000,影响人类的肾上腺、脊髓和中枢神经系统。自1993年X-ALD的致病蛋白ABCD1 被鉴定以来,人们围绕着其生理功能、底物特异性以及底物转运机制进行了大量的研究,并且鉴定了超过900个致病突变位点,但是ABCD1高分辨率三维结构的缺失极大地限制了人们对ABCD1的底物转运机制和相关突变致病机理的理解。
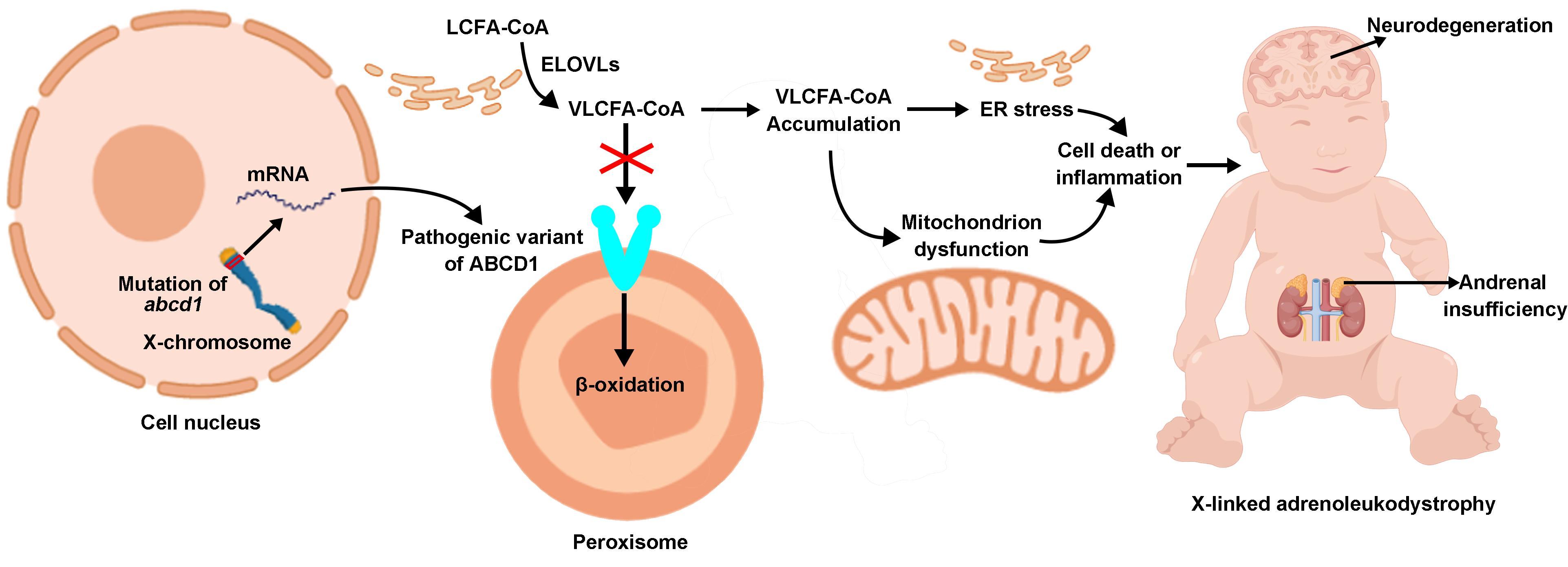
图1. ABCD1功能缺陷导致X-ALD
近日,陈宇星教授和周丛照教授课题组利用单颗粒冷冻电镜技术解析了人类超长链脂酰辅酶A转运蛋白ABCD1的无配基结合(apo-form)、底物结合以及ATP结合三种不同构象的蛋白质结构,整体分辨率分别为3.5、3.6和2.8Å(图2)。基于蛋白质结构分析以及生化分析的结果,作者提出了ABCD1的底物识别与转运机制,相关研究成果以“Structural basis of substrate recognition and translocation by human very long-chain fatty acid transporter ABCD1”为题于2022年06月08日在线发表在《Nature Communications》上。
结构分析表明,apo-form ABCD1结构呈现向细胞质基质开口 (inward-facing)的构象:两个核苷酸结合结构域(NBD)彼此分开,两个跨膜结构域(TMD)形成一个朝向细胞质基质开放的“V”形底物转运通道。结合了底物超长链脂酰辅酶A (C22:0-CoA)的 ABCD1结构仍然采用inward-facing的构象,但是底物的结合诱导两个TMD向ABCD1的二重对称轴移动,导致两个TMD朝向细胞基质的通道变窄,两个NBD相互靠近。两个底物分子以一种独特的结合模式结合在两个TMD上:每个C22:0-CoA分子的3'-磷酸-ADP部分结合在一个TMD的富含正电荷的极性口袋中,泛巯基乙胺部分跨越两个TMD之间的空腔,使得后续的脂酰基链插入到另一个TMD与过氧化物酶体膜形成的疏水口袋中。两个底物分子以二重对称的方式结合在TMD上,生化分析结果表明这两个底物分子的结合具有正协同效应,这种效应是在ABC转运蛋白中第一次被发现。在结合了ATP的ABCD1结构中,ATP的结合导致两个NBD发生二聚化,带动TMD转变为向过氧化物酶体基质开放的构象(outward-facing),而跨膜螺旋的重排导致整个底物结合口袋被破坏。最终,底物被释放到过氧化物酶体基质中。该研究不仅为阐明ABCD1的底物转运机制提供了结构基础,还为研究ABCD1突变导致X-ALD的致病机理提供了分子模型。
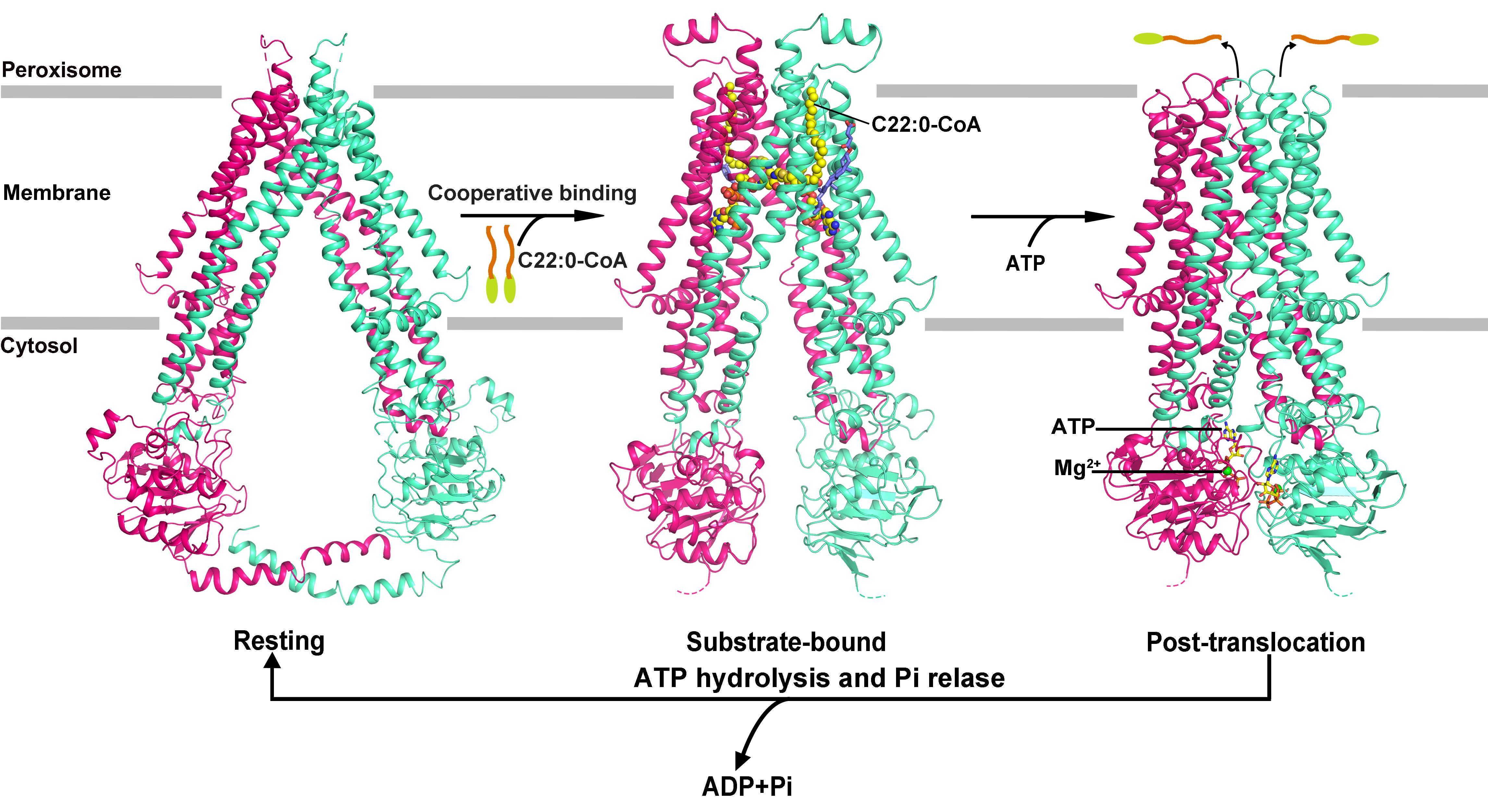
图2.ABCD1的三维结构及其底物转运模型
中国科学技术大学陈宇星教授、周丛照教授和侯文韬副教授为该论文的共同通讯作者,博士生陈志鹏为该论文的第一作者。冷冻电镜数据收集工作在中科院北京生物物理研究所和中国科学技术大学集成影像中心完成。该研究得到了科技部、国家自然科学基金委和中国科学院的资助。
原文链接:https://www.nature.com/articles/s41467-022-30974-5
(生命科学与医学部、科研部)