中国科大发现乳腺癌肿瘤干细胞调控铁死亡及转移的克隆化增殖新机制
3月16日,中国科学技术大学生命医学部朱涛教授课题组在Nature Communications上发表题为Cancer Stem Cell Regulated Phenotypic Plasticity Protects Metastasized Cancer Cells from Ferroptosis的研究论文。
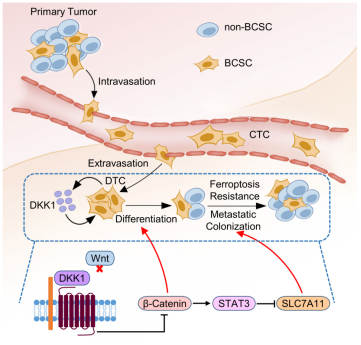
肿瘤干细胞具有自我更新、高度转移和治疗抵抗能力,其在肿瘤的恶性进展中发挥着关键作用。肿瘤干细胞和非肿瘤干细胞群体在肿瘤发展过程中维持着亚群间的动态平衡,每个亚群都可以重构出整个肿瘤细胞群体。但维持肿瘤细胞亚群间动态平衡的机制,及这种现象在肿瘤发生发展中的作用尚不清楚。
课题组首先通过体外共培养及小鼠体内共移植研究体系,发现乳腺癌肿瘤干细胞可以通过分泌细胞因子负反馈抑制其自身干细胞特性。通过高通量筛选、荧光素酶报告等实验,他们发现DKK1在肿瘤干细胞分泌组中发挥关键作用。进一步功能实验表明,肿瘤干细胞调控的自主性抑制作用可以促进远端转移处的肿瘤干细胞脱离静息状态,促进转移灶的克隆化增殖。在多种乳腺癌转移模型中,DKK1的小分子抑制剂几乎可以完全阻断肺转移的发生。
铁死亡是一种非凋亡的细胞死亡过程,与细胞的异常代谢及脂质过氧化相关。相较于原位乳腺癌,肺转移灶处于高活性氧及高铁死亡的压力下。本研究表明,肿瘤干细胞由于其高侵袭特性,在肺转移灶相对富集,富集的肿瘤干细胞可以分泌DKK1负反馈抑制其干细胞特性。由于肿瘤干细胞对铁死亡高度敏感,DKK1调控的肿瘤干细胞特性抑制可以保护肺转移细胞免受铁死亡,促进转移灶的生长。
这项研究创新性提出了抑制肿瘤的转移性克隆化增殖步骤,而非肿瘤侵袭步骤可以有效抑制肿瘤转移的发生。综上,这项工作阐明了肿瘤干细胞调控的表型可塑性在肿瘤转移性定植中的作用,并提供了抑制转移的创新治疗策略。
中国科学技术大学生命医学部武明明和张肖为本文的共同第一作者。中国科学技术大学生命医学部朱涛教授、清华大学深圳国际研究生院Peter E.Lobie教授(科大兼职教授)为本文的共同通讯作者。该研究得到了国家自然科学基金委和科大新医学基金的资助。
文章链接:https://www.nature.com/articles/s41467-022-29018-9
(生命科学与医学部、科研部)