近日,中国科大化学与材料科学学院梁高林教授课题组和袁月教授课题组在肿瘤光声成像方面取得新进展。作者通过肿瘤高表达的组织蛋白酶B(CTSB)调控小分子光声成像探针在细胞内原位自组装成不易被细胞泵出的纳米探针,从而显著增强小鼠乳腺癌肿瘤处的光声成像信号,实现CTSB高表达肿瘤的特异性光声成像。相关研究成果于12月8日以《Cathespin B-Initiated Cypate Nanoparticle Formation for Tumor Photoacoustic Imaging》为文章标题,发表于国际著名学术期刊《Angewandte Chemie International Edition, DOI: 10.1002/anie.202114766》。
对大多数癌症来说,疾病早期的五年存活率远远高于疾病晚期,并且患者也有相对较多的治疗方案可供选择,所以早期诊断对于癌症治疗来说至关重要。CTSB由于在多种癌症早期过表达,因此被认为是一种潜在的早期癌症诊断标志物,准确高效评估体内CTSB的活性将为癌症的早期临床诊断提供新的方法。
光声成像是近年来发展起来的一种非入侵式和非电离式的新型生物医学成像方法,它结合了光学成像的高对比度、特异性以及超声成像的高穿透性,在生物医学研究和疾病分子诊断方面具有巨大的应用潜力。
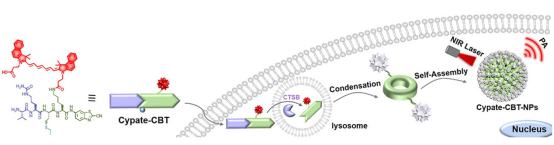
针对癌症早期诊断难题,结合自组装过程对光声成像探针信号的增强作用,作者基于本课题组特色的CBT-Cys点击缩合反应,设计出一种CTSB特异激活的近红外光声成像探针Val-Cit-Cys(SEt)-Lys(Cypate)-CBT(Cypate-CBT)。当Cypate-CBT进入CTSB高表达的肿瘤细胞后,其二硫键被细胞内的谷胱甘肽还原,特定底物Val-Cit被CTSB识别并剪切,生成的产物Cypate-CBT-Cleaved将通过分子间的CBT-Cys点击反应形成环状二聚体Cypate-CBT-Dimer。该二聚体通过π-π堆积自组装成尺寸较大的近红外纳米粒子Cypate-CBT-NPs富集在肿瘤细胞中,从而增强光声成像信号、延长光声检测时间。细胞和动物成像结果表明,与Cypate对照组相比,实验组在乳腺癌细胞和肿瘤中的光声成像信号分别增强了4.9倍和4.7倍。将Cypate-CBT中的Val-Cit片段换成其他酶切序列,利用该策略可以设计出更多的“智能”光声成像探针,为临床上提供精准诊断相应癌症的新思路。
该论文第一作者为中国科大化学与材料科学学院博士生王晨晨,梁高林教授和袁月教授为共同通讯作者。
该研究得到了国家杰出青年科学基金、基金委创新研究群体项目,以及中央高校基本科研业务费专项资金项目的资助。
附文章链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202114766
(化学与材料科学学院、科研部)