分枝杆菌具有非常复杂的包膜结构,从内到外依次为包括细胞质膜、细胞壁(~14nm厚)和荚膜(~35nm厚)。其中,细胞壁由三层共价连接层组成,从内到外依次是:肽聚糖层、阿拉伯半乳聚糖层和糖脂非共价包围的分枝杆菌酸层。这种细胞壁结构是分枝杆菌特有的,并且整个包膜结构交错密集,疏水性强,流动性和通透性差,是分枝杆菌抵御外界压力的天然屏障。由于这种特有的复杂包膜结构,分枝杆菌与外界环境或宿主之间的物质运输具有独特的性质。并且分枝杆菌包膜上的通道可以分泌毒力因子和促进抗生素外排,从而帮助分枝杆菌致病,因此是很好的治疗靶标。但分枝杆菌细胞壁和荚膜上的物质运输通路目前还知之甚少。
近日,以我校微尺度物质科学国家研究中心龚为民教授和加州大学洛杉矶分校(UCLA)的周正洪教授为主的课题组合作在国际著名学术期刊Science Advances在线发表了题为“Identification and architecture of a putative secretion tube across mycobacterial outer envelope”的研究论文,分别通过X射线晶体学和冷冻电镜方法测定了结核分枝杆菌中的未知功能蛋白Rv3705c及其在耻垢分枝杆菌中的同源蛋白MSMEG_6251的三维结构,发现这两个蛋白均能在体外自组装为管状结构。通过一系列分子生物学和生物化学实验显示该蛋白在分枝杆菌外膜上发挥通道作用。因此将该蛋白命名为TiME (Tube-forming proteinin theMycobacterialEnvelope)。

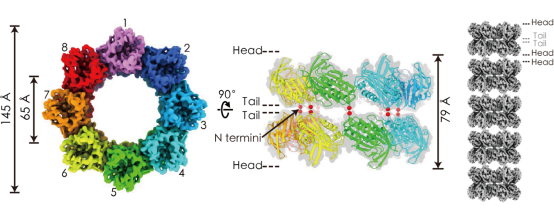
龚为民和周正洪教授的合作研究发现,TiME以八重对称方式形成内径为近60埃的环状结构(图左),两个单层环以tail-to-tail的方式形成双层环(图中),再以双层环为基本单元重复堆叠为管状结构(图右)。耻垢分枝杆菌细胞定位实验证实TiME蛋白主要分布包膜中,特别是在外膜和荚膜中更为丰富。TiME基因敲除后显著降低了耻垢分枝杆菌中分子量小于22Kda的蛋白分泌。如果在细胞培养时用去垢剂破坏荚膜和部分细胞壁,则TiME敲除株与野生菌株的蛋白质分泌没有明显区别,表明TiME蛋白主要在外膜中发挥作用。该研究首次在分枝杆菌荚膜中发现物质运输通道,为研究致病性分枝杆菌的物质运输机制和开发新的药物靶点提供了新的线索和思路。
我校微尺度物质科学国家研究中心龚为民教授和加州大学洛杉矶分校(UCLA)的周正洪教授为该文章的共同通讯作者。中国科大博士蔡潇颖、博士刘磊和硕士邱春红为该文共同第一作者。研究过程中,中国科大田长麟教授和中国科学院生物物理研究所毕利军教授给予了协作与支持。该研究得到了国家自然科学基金委和科技部国家重点研发计划的资助。
原文链接:https://advances.sciencemag.org/content/7/34/eabg5656
(合肥微尺度物质科学国家研究中心、科研部)