中国科学技术大学附属第一医院、生医部孙宝林教授课题组定义并阐释了一组新的调控性蛋白VraCP参与Mu50菌株万古霉素中度耐药发生及细胞壁代谢的分子机制。相关研究成果以“VraCP regulates cell wall metabolism and antibiotic resistance in vancomycin-intermediateStaphylococcus aureus strain Mu50”为题于2021年5月5日在线发表在微生物抗菌领域知名杂志Journal of Antimicrobial Chemotherapy上。
由甲氧西林耐药性金黄色葡萄球菌(methicillin-resistantStaphylococcus aureus,MRSA)导致的感染正严重威胁公共健康安全,万古霉素被用于严重MRSA感染的临床治疗。但近年来,有关万古霉素治疗失败的临床案例被越来越多的报道。然而,万古霉素中度耐药性金黄色葡萄球菌(vancomycin-intermediateStaphylococcus aureus,VISA)发生发展的机制目前仍不是很清楚。
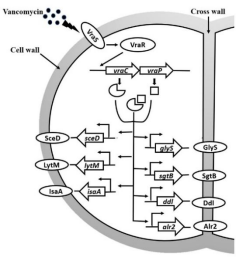
之前的研究显示,vraC、vraP可能与万古霉素耐药性相关,但其背后的机制目前仍未解析。在本研究中,作者选取临床VISA菌株Mu50为研究对象,证实了vraC,vraP以及vraCP在细胞壁代谢及抗生素耐药性发生中的作用。研究显示,vraC与vraP共转录,且响应万古霉素刺激,其各自的表达产物VraC及VraP并不稳定,但它们可在自然状态下形成稳定的蛋白复合物VraCP。与Mu50野生型菌株相比,vraC,vraP及vraCP的敲除均导致菌株呈现出变薄的细胞壁,以及增强的细胞壁相关抗生素敏感性,包括万古霉素、替考拉宁、达托霉素以及苯唑西林。值得注意的是,vraCP的突变可实现VISA到VSSA的转变。进一步研究发现,vraC,vraP和vraCP突变体中细胞壁合成相关酶GlyS、SgtB、Ddl、Alr2的转录水平明显下调,这可能是突变体细胞壁变薄及抗生素敏感性增强的主要原因。此外,vraC,vraP和vraCP突变体的自溶速率也明显减慢。与此同时,细胞壁水解相关基因sceD、lytM、isaA的转录水平也明显下调。EMSA及GFP融合启动子报告实验进一步表明,VraC及VraCP可通过与靶标基因sceD、lytM、isaA的启动子的直接结合,增强启动子活性,从而促进靶标基因sceD、lytM、isaA的表达。而靶基因启动子中的一致性序列(5′-TTGTAAN2AN3TGTAA-3′)在VraCP复合物与靶标基因sceD、lytM、isaA启动子的结合中起着至关重要的作用。以上研究加深了我们对Mu50菌株万古霉素耐药性发生机制的认识,为解析VISA菌株发生发展的机制提供了新的研究思路。
该工作由孙宝林教授课题组的博士生王婉莹完成。该研究得到了中科院B类先导项目(XDB2902000)的资助。
原文链接: https://doi.org/10.1093/jac/dkab113
(生命科学与医学部、科研部)