中国科大揭示了E3泛素连接酶识别羧基端精氨酸-降解决定子的分子机制
高等真核生物细胞通过降解清除不需要或错误折叠的蛋白质以维持胞内蛋白质分子的正常水平及功能,该降解过程主要通过依赖于泛素的蛋白酶体系统(UPS)。在UPS通路中,泛素活化酶E1、泛素结合酶E2和泛素连接酶E3协同催化泛素级联反应,泛素修饰底物并促进其降解。E3连接酶复合物与底物相互作用决定了UPS的特异性。研究表明,E3连接酶复合物中的受体蛋白质通过识别蛋白质氨基端或羧基端特定氨基酸序列调控底物泛素化降解通路,底物末端特征序列分别称做N-degron和C-degron。
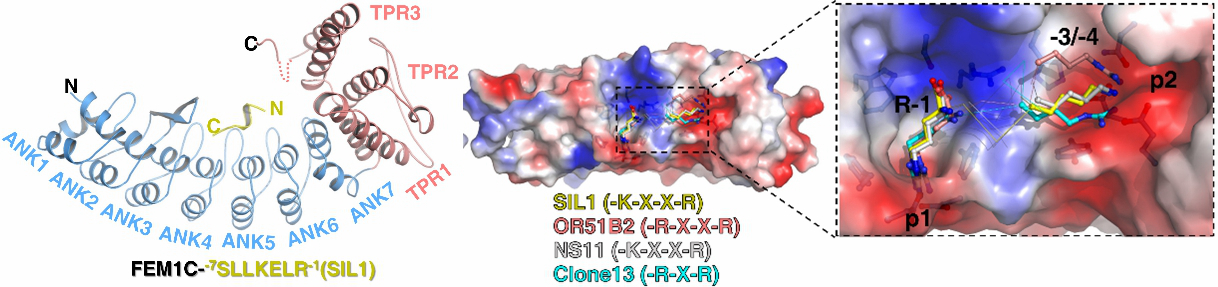
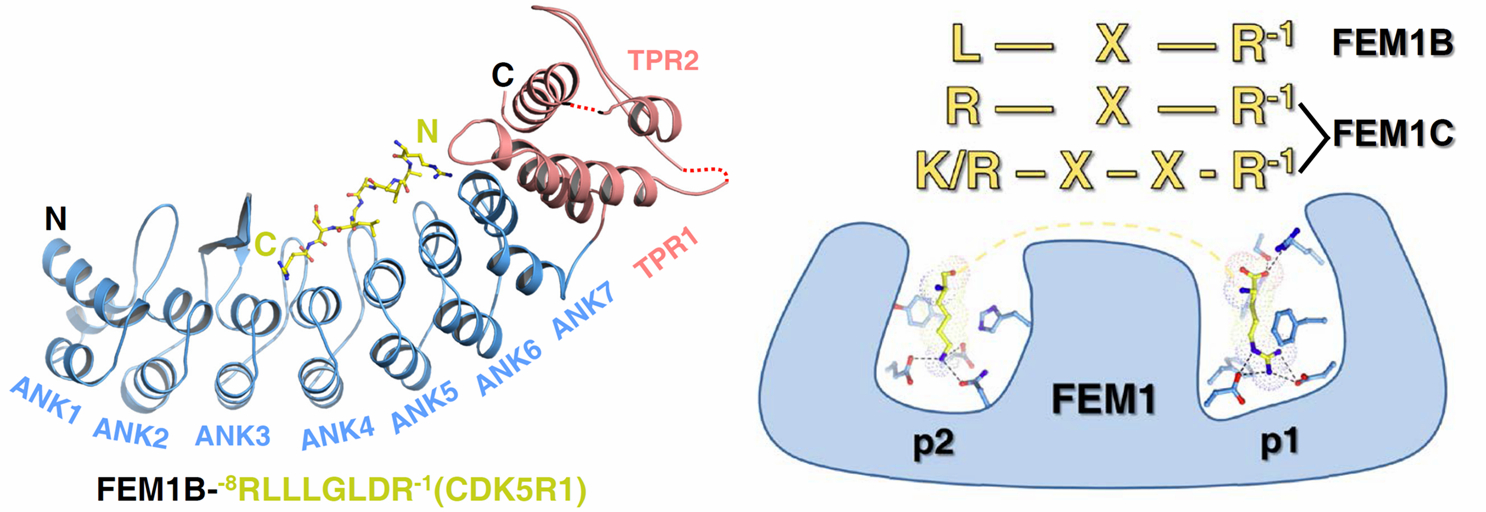
图1 FEM1C、FEM1B选择性识别不同的Arg/C-degron
许超课题组针对Cul2 E3连接酶复合物中的受体蛋白质FEM1家族成员FEM1A、FEM1B、FEM1C开展研究。首先通过结合实验发现FEM1蛋白质均通过氨基端含锚蛋白重复(ankyrin repeats)的区域识别含羧基精氨酸的C-degron (Arg/C-degron),但FEM1A/C与FEM1B体现出了不同的序列偏好性。我们首先解析了FEM1C分别与SIL1、NS11、OR51B2、Clone13的Arg/C-degron的4个复合物晶体结构,通过结构分析发现FEM1C通过双位点模式特异识别含-K/R-X1-2-R的Arg/C-degron;进而解析了FEM1B和CDK5R1 C-degron的复合物晶体结构,并与FEM1C复合物比较,揭示了FEM1B识别CDK5R1 C-degron的-G-L-X-R序列的分子机制。基于结构,我们不仅揭示了FEM1A/C与FEM1B底物不同选择性,还通过突变关键氨基酸将FEM1C向FEM1B改造,使突变后FEM1C偏好性从SIL1(K-X-X-R)转向CDK5R1(G-L-X-R)。最后我们在哺乳动物细胞中构建基于双荧光的蛋白质稳定性全局报告质粒系统(Global Protein Stability, GPS)。在GFP荧光蛋白质末端融合C-degron,发现任何削弱或者破坏C-degron和FEM1蛋白质相互作用的突变都会导致GFP更加稳定,通过体内实验验证了Cul2FEM1 通过识别蛋白质Arg/C-degron有效调控蛋白质泛素化降解过程。
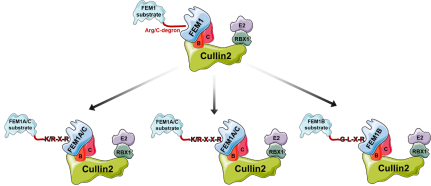
图2 Cul2FEM1 E3复合物通过受体蛋白质FEM1识别Arg/C-degron调控底物稳定性的模型。
该研究共解析了9个FEM1B或FEM1C与C-degron的复合物晶体结构,揭示了Cul2FEM1通过受体FEM1家族成员识别不同Arg/C-degron的分子机制,还基于FEM1的底物识别机制鉴定了更多Cul2FEM1潜在的新底物,并为将来以Cul2FEM1为靶点设计PROTAC型小分子提供了结构基础。相关论文已被《Nature Chemical Biology》接收,于2021年1月4日在线发表。
许超教授课题组博士生陈新颜、特任副研究员廖善晖、Itay Koren课题组的Yaara Makaros为论文的共同第一作者。许超教授和Itay Koren教授为共同通讯作者。该研究得到了中国科学技术大学姚雪彪教授课题组、涂晓明副教授以及朱中良工程师的大力支持。研究工作获得了无膜细胞器与细胞动力学教育部重点实验室、微尺度国家研究中心、自然科学基金委以及中科院先导项目支持。
论文链接:https://www.nature.com/articles/s41589-020-00704-3
(生命科学与医学部、合肥微尺度物质科学国家研究中心、科研部)