近日,中国科学技术大学微尺度物质科学国家研究中心和生命科学与医学部陈宇星教授和周丛照教授课题组与孙林峰教授课题组合作,利用冷冻电镜技术首次解析了人类溶酶体维生素B12外排蛋白ABCD4的近原子分辨率三维结构,为深入理解该类膜蛋白转运的分子机制以及其突变引发疾病的致病机理提供了基础。该研究成果以“Cryo-EM structure of human lysosomal cobalamin exporter ABCD4”为题于2019年8月29日在线发表在《Cell Research》上。
维生素B12仅能在自然界少数细菌和古细菌中合成,而其作为一种人类必需的营养物质,只能从食物中摄取。维生素B12通过受体介导的内吞作用进入细胞,随后以游离形态储存于溶酶体中,需要时外排至细胞质而被利用。研究表明人类ATP结合盒式(ABC)转运蛋白 ABCD4定位于溶酶体膜上,可能在溶酶体内维生素B12外排至细胞质过程中起到关键作用。ABCD4基因的突变可能导致一系列先天性维生素B12缺陷病。其症状表现为肌张力减退、骨髓抑制、巨红细胞性贫血和心脏病等。然而溶酶体内维生素B12外排的分子机制却不清楚,制约了对相关疾病的深入了解和治疗。
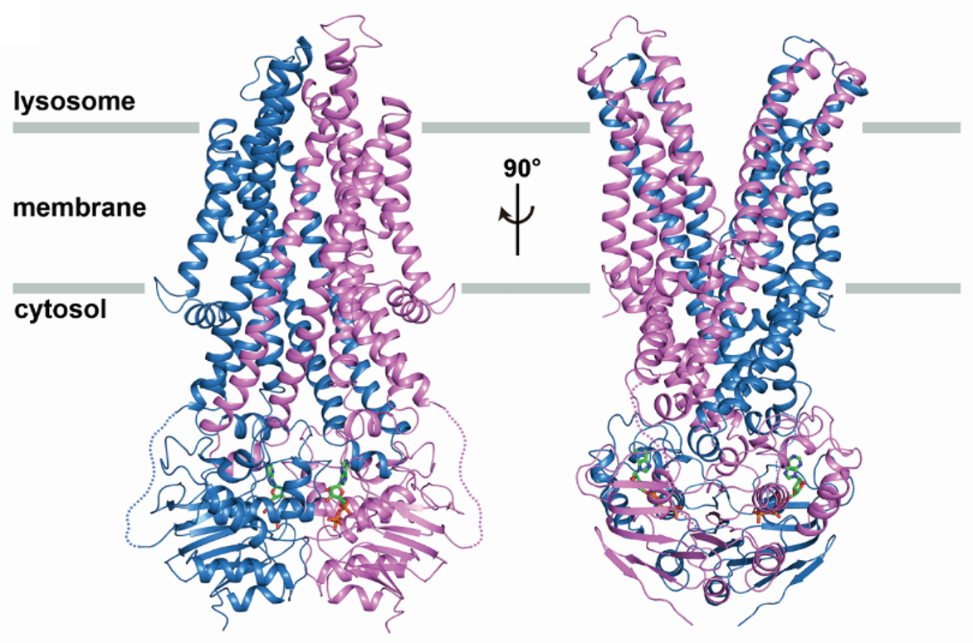
ABC膜转运蛋白作为一类通过结合并水解ATP获得能量实现物质跨膜运输的多次跨膜蛋白,广泛分布于原核和真核生物中。其转运的底物包括离子,氨基酸,短肽,糖类以及脂质等,因而参与多种重要生理功能,并与肿瘤细胞的抗药性密切相关。近些年来,由于单颗粒冷冻电镜技术的飞速发展,一系列的人类ABC膜转运蛋白的分子结构被解析,涵盖了除ABCD亚家族之外的所有亚家族。本文报道的ABCD4结构作为D亚家族第一个三维结构,填补了这一空白。作者经过大量的摸索,成功表达并纯化得到了状态良好的人类ABCD4蛋白,利用单颗粒冷冻电镜技术解析了该蛋白与ATP(三磷酸腺苷)结合状态的高分辨率三维结构,分辨率达到3.6埃(0.36纳米)。该蛋白由606个氨基酸残基组成,以同源二聚体的形式在人体内行使功能。本次解析的结构为生理状态下ABCD4二聚体复合物的结构,包含两个六次跨膜的跨膜结构域(TMD)和两个核酸结合结构域(NBD),整体呈现对溶酶体内开放的构象,其中两个核酸结合结构域各自结合一个ATP分子并二聚化,两个跨膜结构域通过跨膜螺旋的交错形成两扇“翅膀”朝向溶酶体基质打开。
依托该结构提供的蛋白质骨架及侧链空间信息,作者对临床上该蛋白的突变体致病机理进行分析。作者发现,临床样本的突变会破坏蛋白质分子内部(引入二硫键)或与ATP分子之间(盐桥)的相互作用,或者使蛋白错误折叠,最终导致蛋白无法正常催化ATP水解或发生构想变化,引发相关疾病。作者又将这些突变版本的蛋白构建在脂质体上利用生化活性进一步验证了结构分析的预测。同时,基于结构我们提出了ABCD4的转运机制。由于定位于溶酶体膜上,ABCD4采用不同于经典ABC外排蛋白的反向转运机制来外排维生素B12。该项研究不仅对于该类蛋白的分子结构研究具有重要的参考意义,也为相关疾病的致病机理研究以及药物开发设计提供了理论指导。
中国科学技术大学陈宇星教授、周丛照教授和孙林峰教授为该论文的共同通讯作者。中国科学技术大学二年级博士生徐达和已毕业的博士生冯璋为该论文的共同第一作者。冷冻电镜数据收集工作在中科院生物物理所生物成像中心完成。该研究得到了科技部、国家自然科学基金委和中国科学院的资助。
文章链接:https://www.nature.com/articles/s41422-019-0222-z
(合肥微尺度物质科学国家研究中心、生命科学与医学部、科研部)