近日,中国科大生命科学学院、微尺度物质科学国家实验室田长麟教授和微尺度物质科学国家实验室郑晓教授、清华大学杨茂君教授合作,揭示了酵母NADH-泛醌氧化还原酶Ndi1催化电子传递的具体机制,并发现Ndi1中电子传递通路间存在反铁磁量子行为。相关研究成果以“Temperature-Dependent ESR and Computational Studies on Antiferromagnetic Electron Transfer in the Yeast NADH Dehydrogenase Ndi1”为题,发表于《Physical Chemistry Chemical Physics》(Physical Chemistry Chemical Physics, 2017, DOI: 10.1039/C6CP08107J)。
线粒体被认为是细胞中的动力工厂,线粒体内膜上的呼吸链(又称电子传递链)将细胞代谢途径中产生的电子从NADH或FADH2向氧分子(0 2)传递,最终生成ATP,负责为生物体提供能量。酵母Ndi1蛋白是呼吸链中发挥重要作用的一类NADH氧化还原酶,能够以FAD为辅基催化电子从NADH传递给泛醌(UQ)。前期清华大学杨茂君实验室和中国科大田长麟实验室通过合作研究,解析了Ndi1的高分辨率晶体结构及Ndi1与NADH、UQ以及NADH-UQ三种底物复合物的晶体结构,并应用电子自旋共振(Electron Spin Resonance, ESR)方法揭示Ndi1中同时存在两个泛醌(UQ1,UQ11结合位点(Nature 2012, 491 (7424), 478-82)。经典线粒体复合物借助一系列铁硫簇(Fe-S cluster)间的反铁磁相互作用(antiferromagnetism, AFM)介导的“量子隧穿”效应完成电子传递,但Ndi1蛋白中并不含有铁硫簇,其电子传递机制研究具有特殊意义。
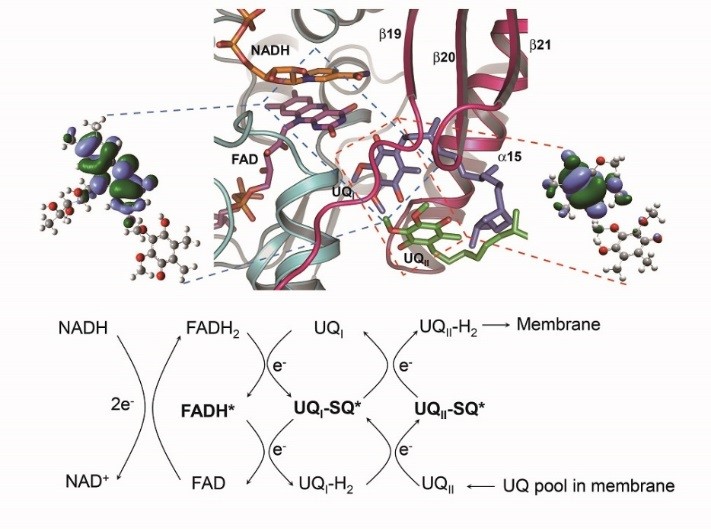
Ndi1蛋白催化的电子传递通路和机制
近期中国科大田长麟实验室、郑晓实验室和清华大学杨茂君实验室密切合作,应用变温ESR方法(200 K-2K)发现Ndi1蛋白中尽管缺失Fe-S簇,其电子传递过程中仍然存在着反铁磁现象(AFM)。通过针对不同Ndi1电子传递中间体的变温ESR谱图拟合分析,获得了反平行电子自旋对之间的海森堡交换耦合常数J,结合量子化学计算方法,系统阐释了Ndi1蛋白中电子从NADH传递到泛醌的通路和机制。结果表明,在Ndi1蛋白电子传递过程中,FAD中间体自由基的b自旋与UQ1半醌自由基的a自旋之间存在着自由基AFM相互作用,当UQ1接受了从FADH2依次传来的两个电子,又将电子依次传递给UQ11,在这一过程中,半醌自由基对(UQ1-UQ11)之间也存在着AFM量子行为。进一步的量化计算和生物功能数据表明,Ndi1催化的电子传递过程中的AFM效应是源于辅基p键堆积(p-stacking)间的through-space交换相互作用。这一研究结果不仅从机理上阐述了Ndi1中的具体电子传递机制,也为研究和应用生物分子的磁学性质提供了新的思路。该研究工作得到了科技部,国家自然科学基金的资助。
(生命科学学院 科研部)